
Новые реалии заставили отечественных фармпроизводителей решать проблемы с поставщиками, выстраивать новые логистические цепочки, искать новые рецептуры. То есть возникла масса задач, связанных с производством. Разумеется, все это привело к изменениям и в регистрационном досье. Их количество заставило задуматься о поиске новых подходов к оптимизации данной работы.
О том, что проблема действительно является острой, говорят и результаты опроса, проведенного сообществом PharmPRO совместно с OOO «НПФ «Материа Медика Холдинг». Участие в нем приняли представители отделов регистрации и обеспечения качества из более чем 70 фармкомпаний. 80% респондентов отметили, что столкнулись с резким увеличением количества изменений в регистрационных досье, о значительном росте заявили 27% опрошенных. Воспользоваться мерами поддержки от государства смогли лишь 32% фармкомпаний. При условии, что более половины лекарственных препаратов в продуктовом портфеле компаний (53%), принявших участие в опросе, зарегистрированы по национальной процедуре. Без оптимизации подходов к изменениям в регистрационном досье, предприятия каждый раз несут серьезные трудовые, финансовые и временные затраты.
По мнению заместителя директора департамента развития производства и регистрации OOO «НПФ «Материа Медика Холдинг» Ирины Красновой, наиболее актуальным на сегодняшний день является управление пострегистрационными изменениями на основе подхода, подкрепленного международным опытом, отраженного в руководстве ICH Q12. Общие принципы, представленные в нем позволяют сделать управление изменениями различных аспектов процесса производства и контроля качества ЛП и АФС, отраженных в разделе «Качество» регистрационного досье, на пострегистрационном этапе более предсказуемым и эффективным.
По словам эксперта, данный подход обеспечит более быстрое внедрение инноваций в процессы производства и контроля качества лекарственных препаратов. Он позволит существенно сократить временные и трудозатраты, связанные с экспертизой и одобрением изменений, сопряженных с высоким риском для качества. В конечном итоге выгодополучателями становятся как пациенты, так непосредственно фармпроизволители. К тому же метод облегчает регуляторному органу оценку предлагаемых изменений и инспектирование.
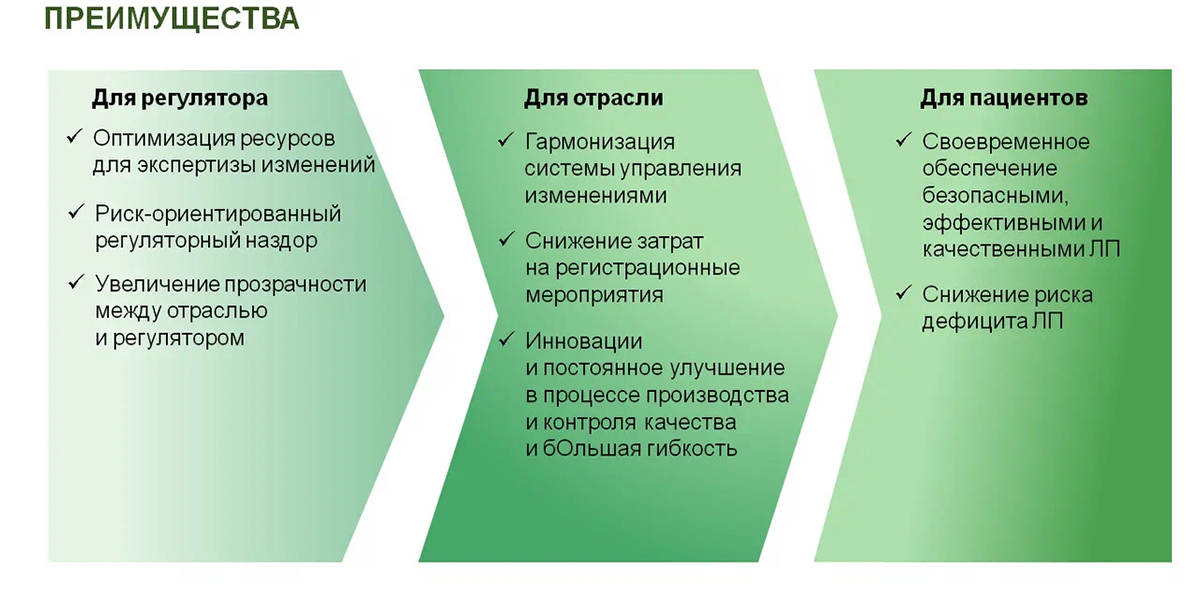 «Имплементация риск-ориентированных подходов к классификации пострегистрационных изменений аспектов производства и качества ICH Q12 позволила бы значительно сократить число регуляторных одобрений до их внедрения, — отметила Ирина Краснова. — Это не только значительно «облегчит жизнь» фармкомпаниям, но и снизит нагрузку на регулятора в части экспертизы регистрационных досье, сохранив ее качества, и, в конечном счете, позволит обеспечить неформальные гарантии обеспечения потребителей качественными, эффективными и безопасными лекарственными средствами».
«Имплементация риск-ориентированных подходов к классификации пострегистрационных изменений аспектов производства и качества ICH Q12 позволила бы значительно сократить число регуляторных одобрений до их внедрения, — отметила Ирина Краснова. — Это не только значительно «облегчит жизнь» фармкомпаниям, но и снизит нагрузку на регулятора в части экспертизы регистрационных досье, сохранив ее качества, и, в конечном счете, позволит обеспечить неформальные гарантии обеспечения потребителей качественными, эффективными и безопасными лекарственными средствами».
Более подробно о новом подходе и своем видении вопроса оптимизации регистрационной стратегии Ирина Краснова рассказала в ходе онлайн встречи с представителями фармкомпаний. Решения, предложенные экспертом, могут быть полезны как для отдельно взятого производителя, так и для всей российской фарминдустрии.
Поделиться