Лоренцо Фаини Директор отдела технической квалификации – PQE Group
Системы кондиционирования воздуха обеспечивают контроль критических параметров окружающей среды (чистота воздуха, давление, температура и влажность) в фармацевтических производственных помещениях. В этой статье мы кратко напомним важность этих основных требований к процессу.
ПАРАМЕТРЫ ОКРУЖАЮЩЕЙ СРЕДЫ И ПРОИЗВОДСТВЕННЫЕ ПРОЦЕССЫ
Контроль уровня чистоты воздуха, то есть ограничение концентрации взвешенных в воздухе частиц, является необходимостью для всех фармацевтических производств, особенно для тех, в которых процессы идут в асептических условиях, и требуется, чтобы системы кондиционирования воздуха обеспечивали необходимый воздухообмен с соответствующей фильтрацией.С другой стороны, существенную роль также играет перепад давления между смежными помещениями, который определяется балансом между приточным и вытяжным воздухом, а также характеристиками герметичности помещений. Это обязательное условие в стерильных цехах, где требуется защита помещений от внешнего загрязнения.В этом случае, в помещениях с высоким классом чистоты поддерживается положительное давление. Перепад давлений настраивается, как правило, по принципу каскада, определяя правильное направление движения воздушных потоков, ориентированных от зон с более высоким классом чистоты к зонам с более низким классом чистоты.Контроль воздушных потоков и перепадов давления также очень важен для предотвращения перекрестной контаминации в цехах по производству твердых пероральных препаратов, где порошки могут распространяться по воздуху, а также в целях удерживания опасных активных ингредиентов, для обеспечения должной защиты операторов и внешней среды. Это применимо, например, в областях, где работают с высокоактивными, гормональными или цитотоксическими веществами.Наконец, тепловые и гигрометрические параметры приобретают важное значение как для состояния продуктов, на стабильность которых они влияют (например, шипучие таблетки), так и для комфорта оператора, а также в отношении защитных костюмов и необходимости ограничить распространение микроорганизмов.Важность и специфика требований к системам отопления, вентиляции и кондиционирования воздуха, связанных с потребностями производственных процессов, требуют строгого выполнения всего процесса ввода в эксплуатацию с постоянным контролем качества и координацией на всех этапах жизненного цикла, включая проект, контракт, управление строительством, вплоть до настройки, испытаний и квалификационных работ.
СПЕЦИФИКАЦИЯ ТРЕБОВАНИЙ ПОЛЬЗОВАТЕЛЯ (URS)
Строгие требования в фармацевтических компаниях касаются эксплуатационных характеристик завода, а также документации и вспомогательных испытаний в связи с тем, что они должны соответствовать стандартам надлежащей производственной практики. Заводы должны не только получить необходимую сертификацию для производства, но и регулярно осуществлять проверки, проводимые регулирующими органами, корпоративными аудиторами или клиентами, в случае производства для третьих сторон.Как правило, при работе в системе качества фармацевтической компании, проект управляется Планом Валидации (или Валидационным мастер-планом в случае особой сложности), с помощью которого планируются дальнейшие действия, документы, которые необходимо подготовить, определяется их минимальное содержание, обязанности и планирование времени.Основным документом, на основе которого строится весь жизненный цикл системы, является Спецификация требований пользователя (URS), составленная и подписанная фармацевтической компанией, которая, при необходимости, пользуется поддержкой внешних экспертов. Этот документ предназначен для четкого, прямого и измеримого описания всего, что клиент ожидает от системы ОВиК, включая технические аспекты, требования, касающиеся установки, функциональности, процесса, качества и нормативных ожиданий.Следуя самому современному подходу к валидации, в соответствии со стандартом ASTM E2500 и Приложением 15 Правил надлежащего производства лекарственных препаратов (GMP), особое внимание следует уделять критическим аспектам установок на каждой стадии жизненного цикла.На практике это означает, что уже в Спецификации требований пользователя (URS) должны быть четко выделены все критические параметры процесса, представленные переменными окружающей среды (класс загрязнения частицами, уровни давления в помещении, температура и влажность) вместе с соответствующими критериями приемлемости, которые четко определены и соответствуют Правилам надлежащего производства лекарственных препаратов (GMP).Казалось бы очевидным, что изменения окружающей среды являются конечной целью и причиной установки системы ОВиК, но иногда бывает так, что система не оправдывает ожиданий, и главная причина в том, что в начальных запросах не было достаточной ясности.Обычно фармацевтическая промышленность подразумевает, что во всех видах деятельности по обеспечению качества будут применены подходы, основанные на оценке рисков и на научном понимание процессов, что позволит распространить анализ рисков на весь жизненный цикл установки.Подход, основанный на оценке рисков, должен применяться с самого начала, и документ Спецификации требований пользователя должен быть рассмотрен представителями отдела обеспечения качества, чтобы обеспечить соблюдение Правил надлежащего производства лекарственных препаратов (GMP) и принятие мер по снижению рисков. С другой стороны, Спецификация требований пользователя также имеет практическую ценность, поскольку она является одним из тендерных документов для выбора поставщика. Выбор правильного поставщика, несомненно, является важным при проектировании и установке системы ОВиК. Не рекомендуется полагаться на поставщиков, которые не имеют опыта в фармацевтической сфере, предпочтительнее рассматривать только поставщиков, которые имеют опыт работы в этом секторе и которые осведомлены обо всем, что они должны будут предоставить, чтобы построить систему, оправдающую ожидания.При выборе поставщика фармацевтическая компания должна провести углубленную оценку, а при необходимости и аудит, целью которого является проверка системы управления качеством поставщика и его технических возможностей.Целью аудиторских проверок является оценка способности поставщика предоставить ожидаемую документацию, провести тесты, проверить предыдущий опыт и рекомендации в этом секторе, а также знание Правил надлежащего производства лекарственных препаратов (GMP) и нормативных требований, включая Правила надлежащей инженерной практики производства лекарственных препаратов (GEP).

КВАЛИФИКАЦИЯ ПРОЕКТА
Как только компанией осуществлён выбор, поставщик выполняет проектирование установки, разрабатывая техническое решение, отвечающее требованиям пользователя. Стадия проектирования включает файл расчетов, схемы машин, воздуховодов, технологические схемы трубопроводов и КИПиА, технические характеристики оборудования и деталей.Обычно проект разрабатывается путем вовлечения клиента в ряд встреч и обсуждений по обзору проекта, которые различаются в зависимости от его сложности.Передовой опыт требует, чтобы перед началом строительства установки была проведена аттестация проекта, известная как «Квалификация проекта», с целью документального подтверждения того, что проект полностью соответствует требованиям пользователя и ожиданиям Правил надлежащего производства лекарственных препаратов (GMP). На практике квалификация проекта разрабатывается как матрица прослеживаемости (матрица трассировки) между требованиями пользователя и спецификациями, чертежами, разработанными поставщиком.На этом этапе, после проектирования, ранее начатая оценка рисков должна быть обновлена в соответствии с фактическими вариантами проектирования.На основе этого планируется четкое выполнение тестов, необходимых для снижения рисков, с очевидным акцентом на критические аспекты и определение критериев приемлемости, которые должны соблюдаться на последующих этапах квалификации.Согласованные действия по тестированию можно запланировать в специальной матрице. После завершения строительства или механомонтажных работ, прежде чем приступить к действительной квалификации, поставщик выполняет наладочные работы, направленные на запуск оборудования.Обычно работы включают в себя:проверку герметичности воздуховода испытание предохранительных устройств проверку установки фильтров чистку приточно-вытяжной установки и воздуховодов проверку вращения двигателя, скорости и силы тока функциональную проверку компонентов (жалюзи, двигатели, выключатели)балансирующие компоненты, которые вращаются измерение вибрации проверку смазочных материалов регулировку давления и температуры регулировку воздушных потоков проверку работоспособности аккумулятора.К сожалению, зачастую этап разработки игнорируется из-за недостатка профессионализма или по причине недостатка времени. В большинстве случаев, фактически, сроки выполнения работ и экономические сроки, которые необходимо соблюдать, очень жесткие, если не невозможные, что серьезно снижает качество работы.Нередко этап формальной квалификации начинается без настройки и надлежащего функционирования системы. Классический, повторяющийся случай, с точки зрения технической квалификации — это испытание перепада давления между соседними помещениями, которое не удается выполнить, поскольку регулировка системы не была выполнена должным образом. Что касается квалификационных тестов, то текущая тенденция такова: как можно больше повторно использовать тесты поставщика, сформулированные в протоколах SAT (Site Acceptance Test / Тест приемки у Заказчика), во избежание бесполезных и дорогостоящих повторений в квалификационных тестах того, что уже было проведено (сделано) поставщиком. Другими словами, нужно делать все хорошо и только один раз.Действия SAT (Тест приемки у Заказчика) также являются частью этапа ввода в эксплуатацию и состоят из тестов правильной установки и работы системы, выполняемых перед тем, как поставщик передаст систему заказчику. После принятия SAT ответственность за систему переходит от поставщика к покупателю.Чтобы поставщик мог осуществлять свою деятельность, проводимые тесты должны быть оформлены в виде протоколов с уровнем качества, равным уровню качества документов, которые обычно используются в мире при квалификации. Также работы должны соответствовать правилам надлежащего производства лекарственных препаратов (GMP), включая согласование и утверждение, как и в отношении бланков протоколов, которые должны быть выполнены, так и в отношении уже выполненных.Обязательным требованием является присутствие заказчика при проведении испытаний.Цель состоит в том, чтобы максимально использовать работу и навыки поставщика, даже если для проверки критических аспектов часто требуются дополнительные действия.
 КВАЛИФИКАЦИЯ СИСТЕМЫ
КВАЛИФИКАЦИЯ СИСТЕМЫ
Квалификация системы ОВиК разрабатывается на этапах КМ (Квалификация монтажа), КФ (Квалификация функционирования), КЭ (Квалификация эксплуатации).Статическая фаза Квалификации монтажа или фаза до начала функционального тестирования, в соответствии с самой современной терминологией, как правило, включает следующие тесты:проверка документации: используется для проверки наличия и состояния архивных документов, сопровождающих систему ОВиК, включая чертежи и спецификации;проверка сертификатов и схем установки фильтров абсолютной очистки;проверка исполнительных чертежей «As-Built»: данная проверка выполняется «на месте» путем сравнения чертежей в их окончательной версии, в частности, технологической схемы трубопроводов и КИПиА, непосредственно с теми, что установлены на месте, для проверки соответствия;проверка установки компонентов: путем визуального осмотра «на месте» можно убедиться, что основные характеристики компонентов системы соответствуют тому, что указано в технических спецификациях;проверка статуса калибровки критического оборудования;проверка рабочих процедур.Динамическая фаза Квалификации функционирования или фаза функционального тестирования, включает в себя следующие тесты:проверка на целостность и тест потери давления фильтров абсолютной очистки: это испытание проводится для демонстрации того, что каждый фильтр исправен и правильно установлен, путем проверки «на месте» проникновения частиц, а также потери давления (степень засорения). В стандарте ISO 14644-3 предусмотрены две процедуры (процедуры B.6.2 и B.6.3), которые, соответственно, включают использование фотометра и счетчика частиц для измерения проникновения дыма, создаваемого генератором аэрозолей. Первая процедура, хотя и более инвазивная, но наиболее известна и широко распространена;проверка расхода и воздухообмена в соответствии с ISO 14644-3 (процедура B.4). Воздухообмен рассчитывается после измерения расхода воздуха в помещениях и затем сравнивается с критериями приемлемости, которые обычно предусматривают кратность воздухообмена 20 раз в час для класса D и более высокие значения для соответственно более высоких классов (см. Руководство ISPE (МАФИ) по системам HVAC (ОВиК) и руководство FDA «Стерильные лекарственные препараты, произведенные путем асептической обработки — cGMP»). Следует отметить, что измерения воздушных потоков никогда не бывают очень точными и могут иметь погрешности порядка +/- 10%;проверка перепада давлений в соответствии со стандартом ISO 14644-3 (процедура B.5);проверка температуры и относительной влажности (процедуры B.8 и B.9). Для термогигрометрического картирования исследуемая область делится на равные площади с помощью воображаемой сетки, чтобы равномерно покрыть комнаты. Измерения должны длиться не менее 5 минут, при этом значение должно регистрироваться не реже, чем каждую минуту. В случае складских помещений с полками или высотой больше, чем у обычных помещений, используется карта с регистраторами данных, размещенными на основе оценки рисков;проверка класса загрязнения частицами по методу стандарта ISO 14644-1. В фармацевтической среде обычно контролируются частицы с размерами ≥ 0,5 мкм и 5 мкм в соответствии с Приложением 1 к GMP. В результате пересмотра Приложения 1 к GMP будут введены изменения, поскольку проверка концентрации частиц размером ≥ 5 мкм в соответствии с пределами стандарта ISO 14644-1 больше не требуется для классификации во время первой квалификации чистых помещений. Контроль количества частиц ≥ 5 мкм останется только для деятельности по постоянному мониторингу нежизнеспособных частиц. Это может привести к значительному сокращению времени отбора проб для помещений классов A и B.Для нового чистого помещения стандарт ISO 14644-1 требует повторения подсчета концентрации частиц при следующих условиях:Построенное (as-built): состояние, в котором монтаж чистого помещения завершен, все обслуживающие системы подключены, но отсутствует производственное оборудование, материалы и персонал.Оснащенное (at-rest): состояние, в котором чистое помещение укомплектовано оборудованием и действует по соглашению между заказчиком и исполнителем, но персонал отсутствует (проверка в условиях «эксплуатации» проводится в КЭ).Определение времени восстановления (Clean Up time Test) (стандарт ISO 14644-3, процедура B.12): испытание, направленное на измерение времени, необходимого для работы системы отопления, вентиляции и кондиционирования воздуха после искусственного увеличения концентрации частиц посредством воздухообмена, для того, чтобы проверить свойство системы восстанавливать ожидаемые условия окружающей среды. Этот тест не рекомендуется для менее чистых классов, таких как D.Дым тест / Smoke test (визуализация потока): с помощью дымогенератора и высокоскоростной цифровой камеры, тест визуально демонстрирует тенденцию воздушных потоков с особым упором на их ламинарность.Этап квалификации эксплуатационных качеств включает в себя следующие тесты:проверка класса загрязнения частицами в условиях «эксплуатации» в согласованные условия, чистая комната тестируется с работающим оборудованием и с определенным количеством присутствующего персонала.проверка микробной контаминации в соответствии с Приложением 1 к GMP. Включает в себя статический, динамический и поверхностный отбор проб.Матрица прослеживаемости между тестами и требованиями пользователя вместе с ранее подготовленным анализом рисков обновляется и проверяется в конце квалификационных мероприятий.По окончании всего процесса квалификации системы помещения можно использовать в производстве.

ПОСТ КВАЛИФИКАЦИОННАЯ ДЕЯТЕЛЬНОСТЬ
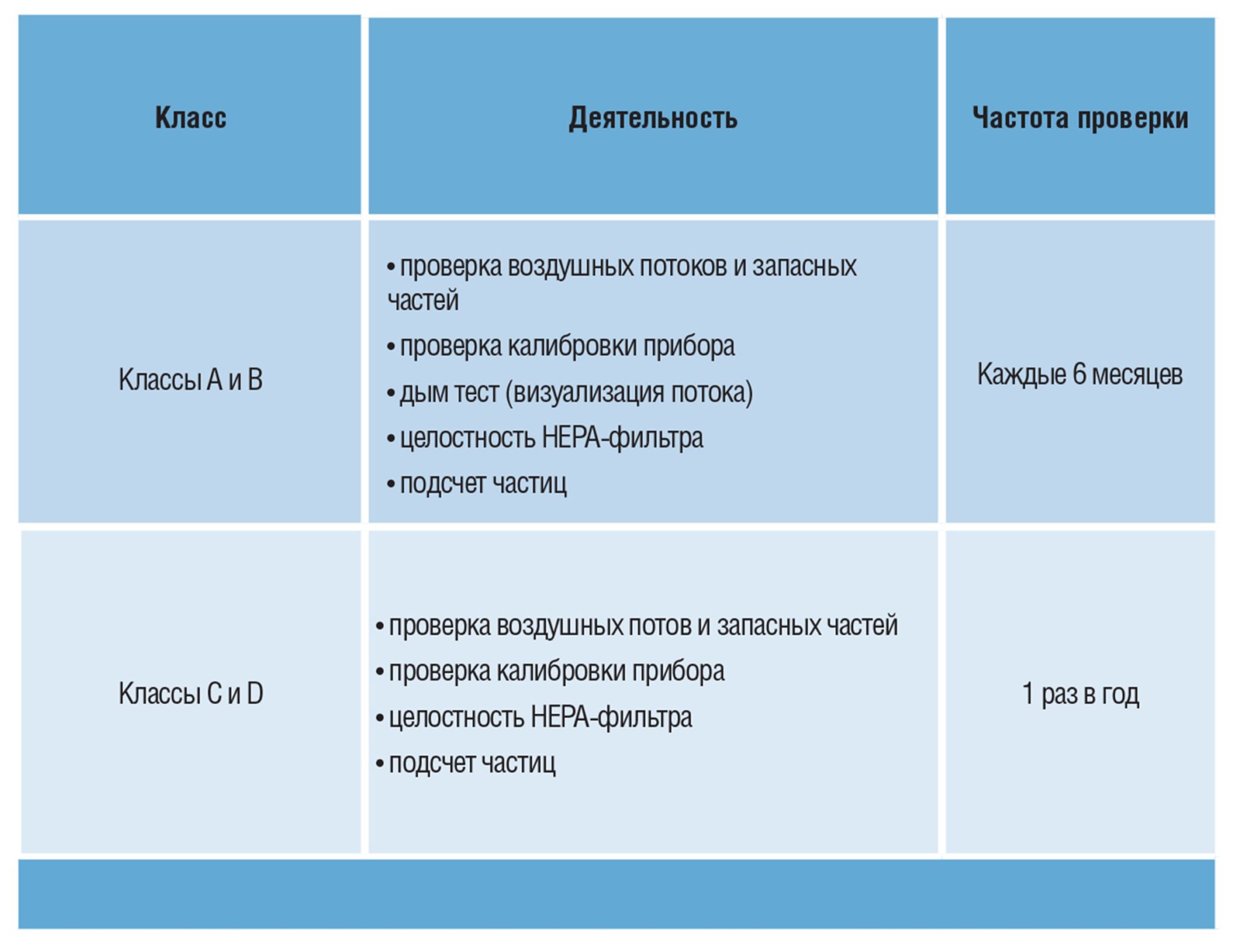
На этом этапе в игру вступают мониторинг окружающей (производственной) среды, переквалификация и периодическое техническое обслуживание. Мониторинг окружающей среды необходим не только для стерильных помещений, но и для тех, в которых производятся нестерильные фармацевтические формы, такие как пероральные жидкости или твердые вещества. Эти действия обычно выполняются отделом валидации и лабораторией контроля качества фармацевтических компаний и предусматривают периодические проверки на предмет загрязнения частицами и микроорганизмами. Выбор количества и положения точек отбора проб, а также частоты повторения испытаний должен основываться на анализе рисков. В соответствии с принципами Приложения 15 к GMP система отопления, вентиляции и кондиционирования воздуха, а также все критические системы, которые оказывают прямое влияние на качество продукции, должны периодически проходить повторную аттестацию для подтверждения действительности статуса квалификации.Общепринятый стандарт для типа и частоты квалификационных испытаний показан в таблице 1.Таблица 1. Общепринятый стандарт для типа и частоты квалификационных испытаний Инспекторы ожидают, что приборы, находящиеся в системе ОВиК, будут включены в программу периодической калибровки и классифицированы в соответствии с анализом рисков. также требуется, чтобы существовали утвержденные процедуры калибровки и соответствующие отчеты были доступны и хранились в соответствии с целостностью данных.Аналогичная ситуация применима к процедурам и записям по техническому обслуживанию — фундаментальному аспекту обеспечения правильной работы, долговечности и безопасности системы ОВиК. Несоответствующее обслуживание может привести к неожиданным и продолжительным простоям, а также к ухудшению рабочих характеристик при обеспечении условий окружающей среды.Профилактическое обслуживание (PdM) позволяет выявить возможную проблему на ранней стадии, используя инструменты/приборы, которые обнаруживают изменения рабочей температуры, вибрацию и износ подшипников.Таким образом, можно активно предотвращать сбои до того, как произойдет значительное ухудшение производительности или возникнет серьезная проблема, такая как остановка производственных операций или запрос на более дорогой ремонт, чем планировалось.Чистота и аккуратный внешний вид технических помещений также являются важными показателями качества обслуживания, выполняемого на оборудовании.Остатки металла, грязи, мусора или запасных частей могут создать у инспектора помещений и технических участков впечатление, что техническое обслуживание выполнено ненадлежащим образом.Традиционные (плановые) методы профилактического обслуживания включают операции, влияющие на различные части оборудования и производства.Прежде всего, приточно-вытяжную установку необходимо периодически проверять на предмет утечки воздуха, наличия ржавчины или скопления грязи, проблем с отводом конденсата и правильности функционирования различных устройств, таких как заслонки, приводы, лампочки и переключатели.Обслуживание дверей и уплотнителей также важно для обеспечения герметичности.Фильтры предварительной очистки, расположенные на входе внешнего воздуха у кондиционеров, не могут удалить все твердые частицы и скопления грязи, которые со временем могут привести к росту микробов.По этой причине, особенно при работе с машинами, обслуживающими стерильные помещения, рекомендуется проводить периодические внутренние проверки и чистку, включая фильтры, змеевики, каплеуловители, поддоны и трубопроводы для конденсата, а также увлажнители, вентиляторы и жалюзи.Обычно агрегаты дезинфицируют бактерицидным и обезжиривающим раствором. Очевидно, что любые следы ржавчины следует удалить, а поверхность перекрасить, чтобы внешний вид был соответствующим. Хорошее состояние вентилятора необходимо для обеспечения проектной производительности и включает в себя несколько компонентов: крыльчатку, корпус, подшипники, ремень и двигатель. Рабочее колесо необходимо содержать в чистоте и оно должно быть откалибровано так, чтобы избежать вибраций и усталостного изнашивания. Во время проверки необходимо прислушиваться к производимым шумам и оценивать вибрацию и температуру двигателей, лучше всего с помощью специальных инструментов. Обычно срок службы двигателей составляет много лет: относительные периодические проверки должны включать внешнюю очистку, поскольку грязь, накапливающаяся в каналах охлаждающего воздуха, может вызвать перегрев.Ременные приводы нуждаются в более частом обслуживании и особое внимание следует уделять проверке относительного натяжения.Смазка подшипников должна быть достаточной, но не чрезмерной, потому что вязкая смазка и масло могут одерживать грязь и повредить подшипники; смазка также должна производиться из продуктов, совместимых с материалом подшипников. Змеевики нагрева и охлаждения/осушения более склонны к накоплению грязи, поскольку они холодные и обычно влажные. Их необходимо очищать ежегодно снаружи.Важно проверить целостность алюминиевых ребер змеевиков, которые не должны иметь повреждений.Внутренняя очистка водяных змеевиков рекомендуется, когда падение давления воды превышает определенный предел. Обратные клапаны также должны быть включены в график периодического технического обслуживания.Контроль паровых увлажнителей воздуха включает чистку фильтра и уплотнения.Очистка фильтров важна не только по причинам, связанным с производительностью системы, но также из-за энергетических затрат, возникающих при увеличении перепада давления.Проверку фильтров следует проводить не реже двух раз в год. Частота промывки фильтров предварительной очистки или замены рукавных фильтров (пылеуловителей) зависит от условий окружающей среды, однако рекомендуется заменять фильтры через два года эксплуатации.Что касается фильтров HEPA, то действия обслуживающего персонала совмещаются с квалификационными работами, связанными с полугодовыми или ежегодными проверками целостности.
ВЫВОДЫ
Мероприятия по техническому обслуживанию и периодические испытания по переквалификации необходимы не только для поддержания первоначальной производительности в течение долгого времени, но также часто являются предметом запросов от регулирующих органов, сделанных во время проверок.
*Ключевые слова: ОВиК – план валидации – Спецификация требований пользователя (URS) – квалификация проекта – КМ (Квалификация монтажа) / КФ (Квалификация функционирования) / КЭ (Квалификация эксплуатации) – ISO 14644-3 – профилактическое обслуживание.
 Контакты:
Контакты:
Адрес: 127015, Москва, ул. Новодмитровская 2к2 БЦ Савёловский Сити, башня Davis
Телефон: +7 (495) 133 98 36
E-mail: ru.info@pqegroup.ru
Web: www.pqegroup.ru






