Автор: Кристиан Зейн, Дуг Подольски, Джейн Вайцель, Рави Редди, Стивен Л. Уолфиш.
Фармакопея США и другие основные фармакопеи установили, что заключение о соответствии продукции официальным требованиям качества должно выноситься только при совместном использовании нормативных документов и фармакопейных стандартных образцов (ФСО). Таким образом, использование нефармакопейных стандартных образцов для фармакопейных методов анализа является недостаточным для вынесения окончательного заключения, и пользователь несет ответственность на свой страх и риск. Для качественных и количественных анализов часто используются вторичные СО. В этой статье представлен обзор ключевых рисков, которые могут быть связаны с использованием вторичных СО и которые возникают из-за неопределенностей измерений, присущих данному подходу, а также информация, которая может помочь в некоторой степени смягчить эти риски. Примеры анализов случаев приведены для иллюстрации научных проблем, связанных с переходом с фармакопейных СО на вторичные СО. Для наглядной визуализации риска рассматривается принцип защитной полосы.
Для обеспечения безопасности и эффективности АФИ и их готовых лекарственных форм необходимо, чтобы эти фармацевтические средства имели определенный уровень качества. Фармакопея США (USP) и другие фармакопеи устанавливают государственные фармакопейные стандарты для обеспечения требований к качеству. Разработка таких фармакопейных стандартов и их доработанных и исправленных изданий осуществляется в рамках прозрачного процесса. Эти стандарты очень актуальны, поскольку помогают облегчить доступ к недорогим лекарственным средствам (1), и они почти всегда имеют официальный статус. Вместе с тем они представляют особую важность для фармацевтической промышленности, так как помимо прочего сокращают затраты на разработку фармацевтических средств (2). Ценность фармакопейных стандартов также описана в недавно выпущенном официальном докладе, представленном на Международном совещании мировых фармакопей под эгидой Всемирной
организации здравоохранения (3).
Как правило, фармакопейный стандарт представляет собой комбинацию нормативного документа, такого как фармакопейная статья или общая статья, и связанного с ним стандартного образца определенного вещества (СО). Эти фармакопейные СО являются первичными СО и устанавливаются посредством проведения совместных исследований с использованием строгих методов; они имеют официальный статус при привязке их к фармакопейным стандартам (4) и, следовательно, обычно принимаются регуляторными органами без дополнительной аттестации со стороны пользователей. Оценка соответствия фармацевтического средства требованиям официального фармакопейного стандарта осуществляется только при совместном использовании нормативной документации и фармакопейного СО. Например, в Европейской фармакопее (ЕФ), общая статья 5.12, говорится следующее (5): «Стандартный образец Европейской фармакопеи, указанный в фармакопейной статье или общей статье, представляет собой официальный стандартный образец, который является единственным определяющим критерием в случае сомнений или споров». В общих положениях Фармакопеи США (USP), раздел 5.80, указывается, что (6): «Если для проведения испытаний или количественных анализов USP или NF [Национального формуляра] требуются стандартные образцы USP, только результаты, полученные с использованием указанного стандартного образца USP, являются окончательными».
Следовательно, использование других (т.е. неофициальных) СО в сочетании с нормативным документом не является окончательным или определяющим для вынесения заключения. Выпуск или оценка соответствия фармацевтического средства на основании такой комбинации осуществляются исключительно под ответственность пользователей на их страх и риск, как и при использовании вторичных СО, даже если они были получены путем квалификации с соответствующими фармакопейными СО.
Цель данной статьи – предоставить примеры случаев, иллюстрирующие научные проблемы, связанные с переходом с фармакопейных СО на вторичные. Эта тема рассматривается с точки зрения неопределенностей измерений, которые связаны с окончательными значениями, полученными с использованием фармакопейных стандартов, а также того, как все может измениться при переходе с фармакопейных СО на вторичные СО. Расчеты неопределенностей измерений при использовании фармакопейных стандартов представлены в разделе «Методы», а информация о проблемах перехода с фармакопейных СО на вторичные СО представлена в разделе «Обсуждение». В этой статье будут рассматриваться только неопределенности для установления характеристик фармакопейных и вторичных СО и для результатов количественного анализа тестируемого вещества. Существуют и другие составляющие неопределенностей, которые могут влиять на результаты измерений, например влияние на СО однородности и долгосрочной стабильности (7), но они в данной статье не рассматриваются.
Авторы понимают, что выполненные здесь расчеты недоступны большинству пользователей по техническим причинам. Неопределенности для фармакопейных СО не приводятся, так как нет необходимости для их официального использования в фармакопейной статье. Фармакопейные СО не предназначены для присвоения количественных значений вторичным СО или установления отношений прослеживаемости между ними, поскольку это нефармакопейные применения. Поэтому пользователям сложно достоверно оценить влияние и критерии приемлемости, которое оказывает переход с фармакопейных СО на вторичные СО. Это ограничение было четко обозначено для фармсообщества (8). Тем не менее, с помощью этого подхода можно наглядно представить влияние на области принятия и отклонения.
МЕТОДЫ
Авторы рассмотрели несколько СО USP и соответствующие данные для расчета присвоенного значения. В приведенных ниже примерах показаны различия между двумя типами моделей, используемых для расчета количественного значения первичного СО.
- Тип 1 соответствует модели, в которой все примеси были определены в весовых процентах (масс. доля) и просто вычитались из 100% (масс. доля).
- Тип 2 соответствует модели, в которой хроматографические примеси рассматривались как относительные проценты. Все остальные составляющие (например, вода, сульфатная зола, были выражены в весовых процентах, которые нужно вычитать из 100% (масс. доля) перед умножением на хроматографическую чистоту.
Для представления каждого типа был выбран реальный фармакопейный СО. Из соображений конфиденциальности в данной статье они называются СО суррогатина гидрохлорида (HCl) для типа 1 и СО репласпама для типа 2.
Количественное значение тестируемого вещества (ТВ) рассчитывается по уравнению 1 и состоит из двух компонентов:
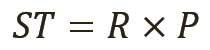
[уравн. 1]
Как описано в разделе 8.2.2 руководства Eurachem (Европейское общество по аналитической химии) по количественной оценке неопределенности в аналитических измерениях (QUAM) (10), общая взаимосвязь между суммарной стандартной неопределенностью uc(y) значения y и неопределенностью независимых параметров x1, x2, …xn, от которых она зависит, показана в уравнении 2:
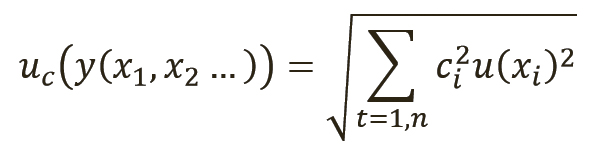
[уравн. 2]
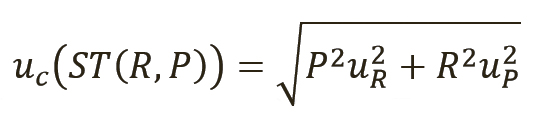
[уравн. 3]
Для фармакопейных СО, представленных в следующих разделах, все измерения, необходимые для расчета окончательного количественного значения, были определены в трех разных лабораториях (т.е. стандартные отклонения были получены на прецизионном уровне воспроизводимости). Неопределенность рассчитывалась с использованием (относительных) стандартных отклонений этих измерений.
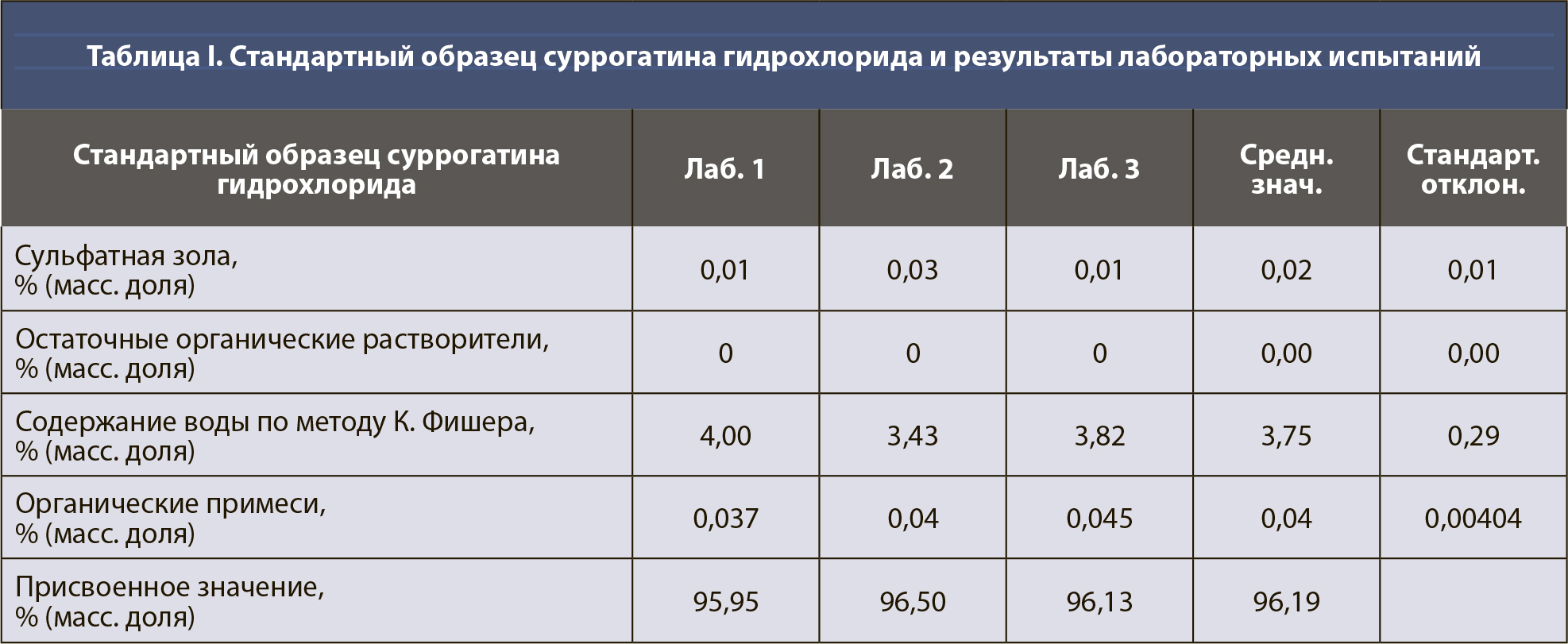
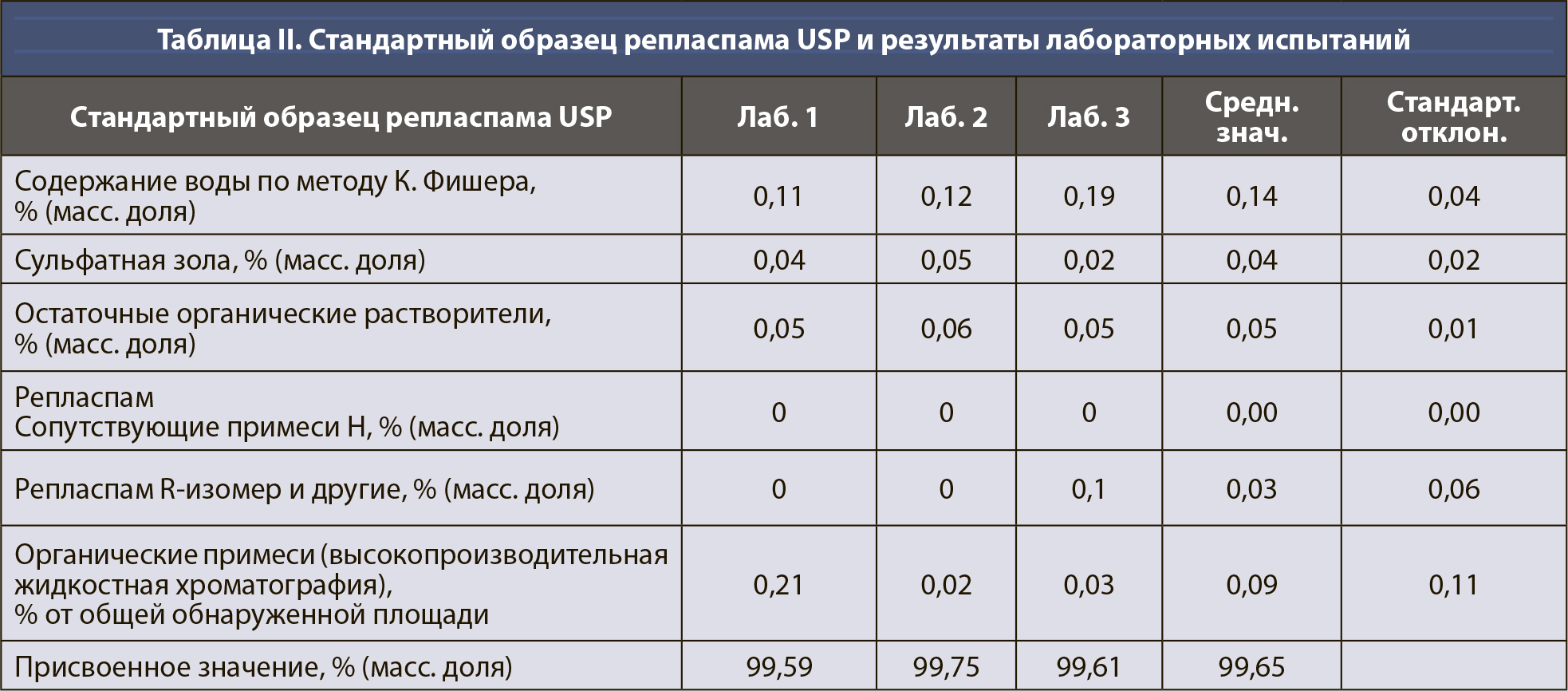
Расчет неопределенности для количественного значения фармакопейных СО, тип случая 1. В таблице I приведены примерные данные для СО суррогатина HCl, включая результаты испытаний, полученные лабораториями, которые проводили исследования, имеющие отношение к расчету количественного значения. Все органические и неорганические примеси (сульфатная зола, остаточные органические растворители, содержание воды по методу К. Фишера [КФ], органические примеси [I]) определялись в весовых процентах.
Таким образом, присвоенное значение (P) этого СО было рассчитано по уравнению 4, с вычитанием всех составляющих отдельных примесей из 100% (масс. доля).
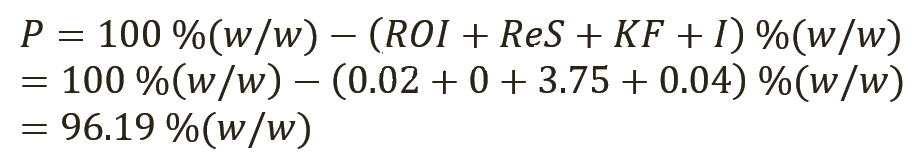
[уравн. 4]
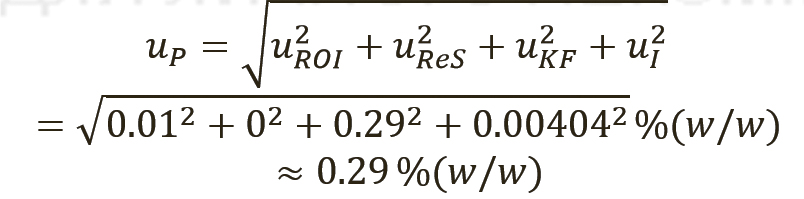
[уравн. 5]
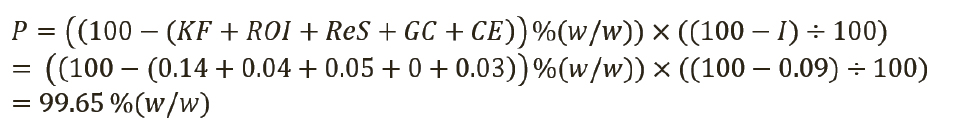
[уравн. 6]
Уравнение 6 содержит как сумму/разность, так и произведение/частное. Как рекомендовано в разделе 8.2.7 Eurachem QUAM (10), суммарная стандартная неопределенность определяется при совместном использовании правил 1 и 2. Следовательно, промежуточная неопределенность для первой части произведения «(100-(KF+ROI+ReS+G-C+CE)) %(w/w)» будет рассчитываться отдельно с использованием правила 1. Для второй части «(100–I):100» необходимо учитывать только неопределенность для органических примесей (I). Эти промежуточные неопределенности затем будут связаны вместе с суммарной стандартной неопределенностью для количественного значения СО USP. Уравнение 7 используется для расчета промежуточной неопределенности uInt по правилу 1 для конкретной части «(100-(KF+ROI+ReS+GC+CE)) %(w/w)»:
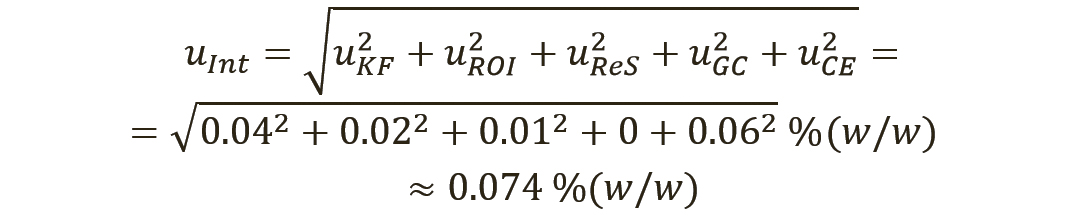
[уравн. 7]
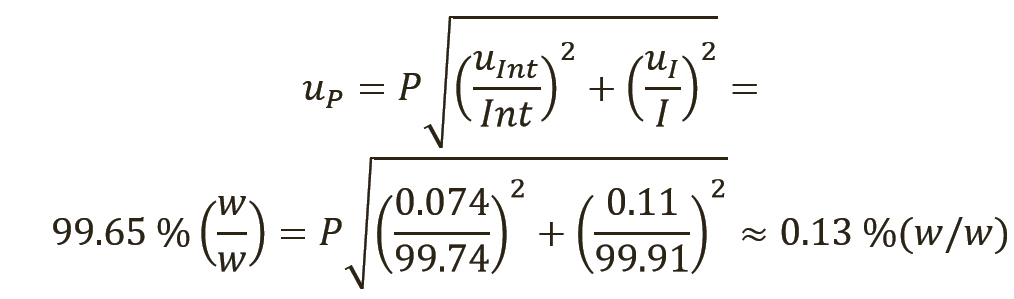
[уравн. 8]
Расчет результатов испытаний и расширенных неопределенностей. Расчет результатов испытаний и неопределенностей производится по уравнениям 1 и 3 соответственно. В уравнении 3 неопределенность отношения uR является последним фактором, который следует учитывать.
Отношение R определяется по площадям пиков, коэффициентам отклика или относительной активности при сравнении неизвестного образца (ST) с первичным СО (P) (9). Для представленных здесь случаев отношение определяется путем сравнения площадей пиков неизвестного образца (ST) и первичного СО (P) и для простоты может быть установлено в первом приближении равным 1 (уравнение 9), поскольку обычно сравниваются площади пиков одинакового размера.
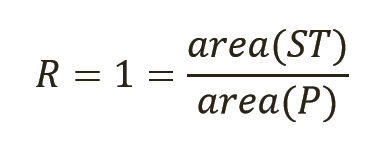
[уравн. 9]
Затем можно рассчитать неопределенность uR отношения, применяя описанное выше правило 2 (уравнение 10). Члены под квадратным корнем представляют собой относительные стандартные отклонения (ОСО) хроматографического метода, используемого для определения площадей основных пиков, см. также раздел 8.2.6 Eurachem QAMM (10). Авторы принимают значение 0,2% для ОСО метода как для суррогатина HCl, так и для репласпама, описанного выше. Следует использовать ОСО фактического метода, но ОСО обычно имеют примерно такие же значения, в зависимости от точности измерения (т.е. повторяемости, внутрилабораторной прецизионности, воспроизводимости), используемой для определения ОСО (см. таблицу III).
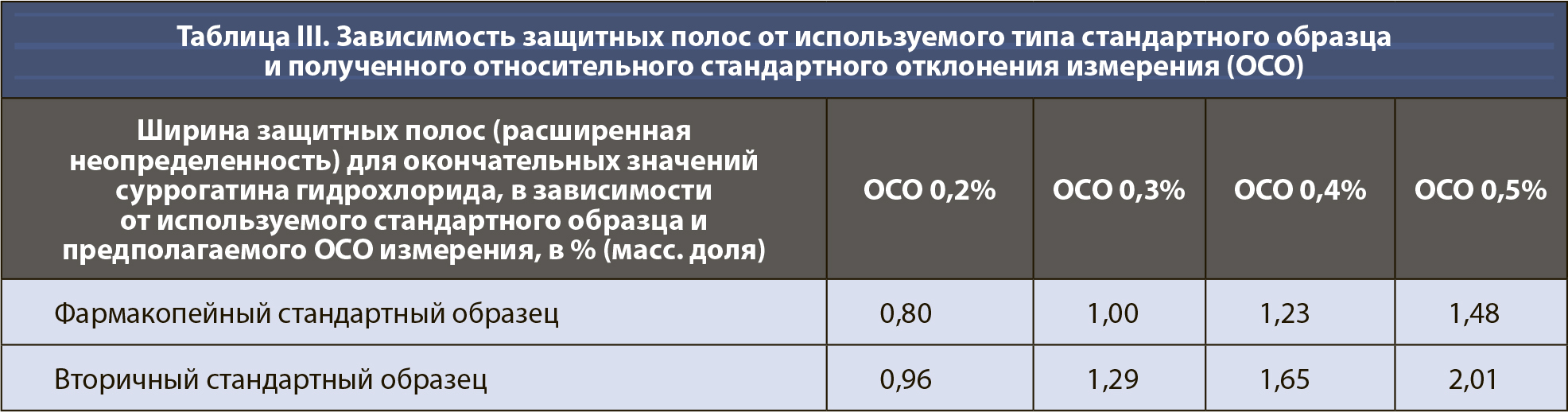
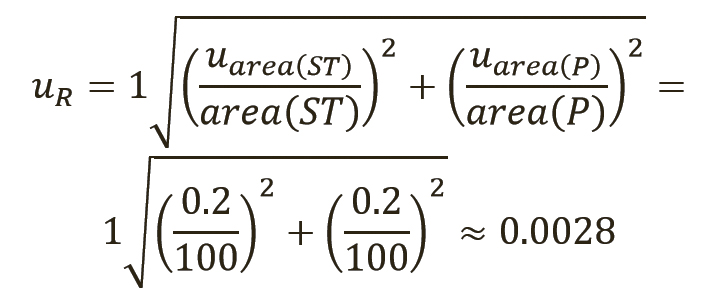
[уравн. 10]
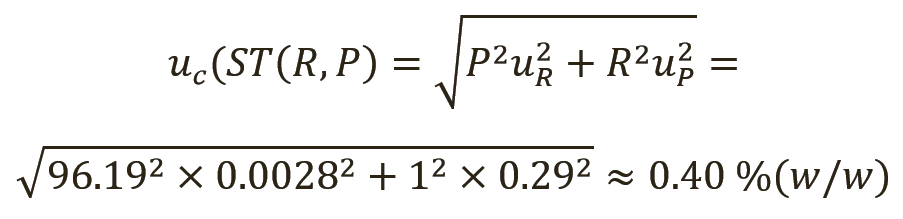
[уравн. 11]
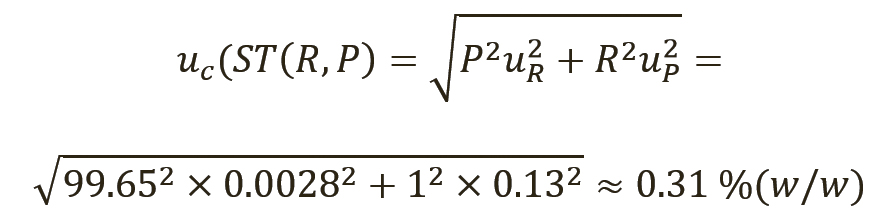
[уравн. 12]
- для суррогатина HCl с расширенной неопределенностью ±0,80% (масс. доля) (k=2, 95% CL);
- для репласпама с расширенной неопределенностью ±0,62% (масс. доля) (k=2, 95% CL).
Эти расширенные неопределенности имеют первостепенное значение для последующего обсуждения, где рассматривается концепция защитных полос.
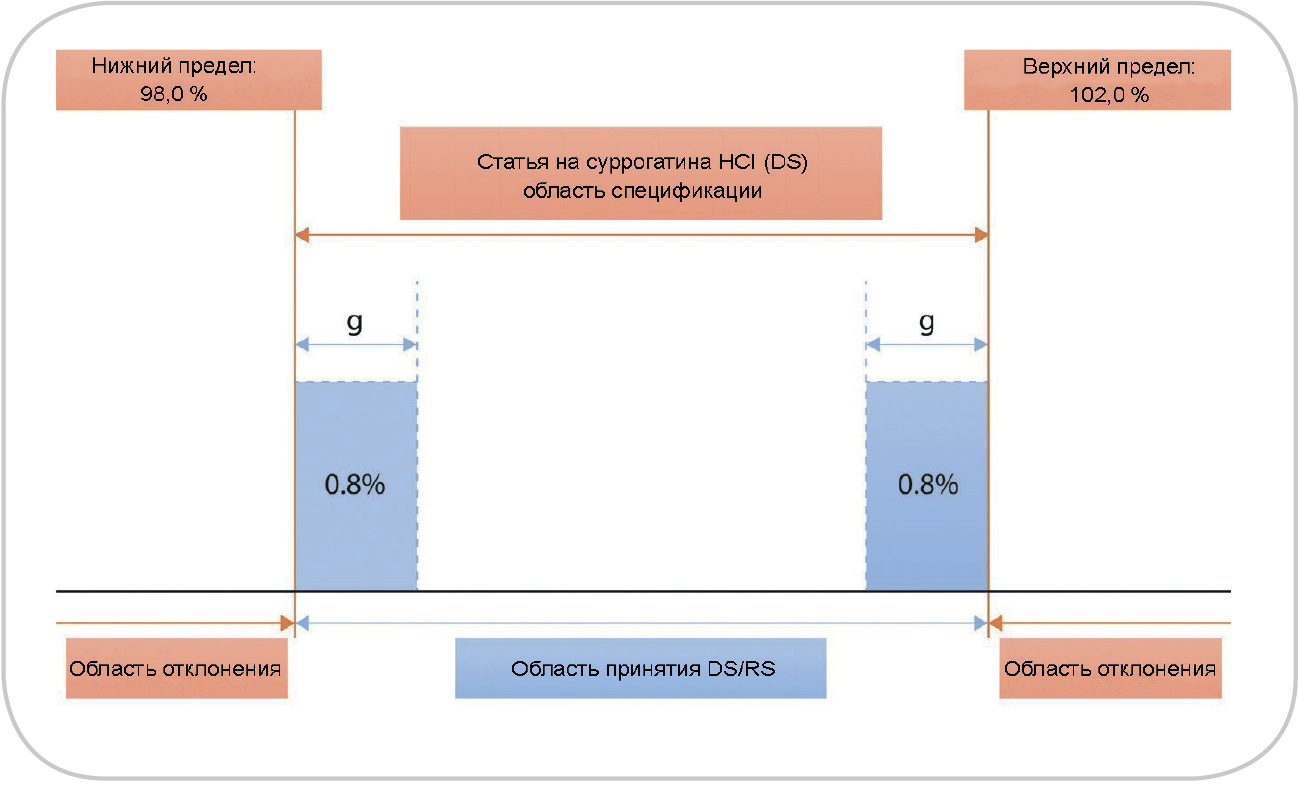
Рис. 1. Схематическое изображение областей принятия и отклонения одновременно для верхнего и нижнего пределов.
Защитная полоса (g) обычно равна расширенной неопределенности результата измерения
ОБСУЖДЕНИЕ
Принцип защитных полос обычно используется при подтверждении соответствия качества. Он учитывает расширенные неопределенности аналитических методов, включая используемые СО, как указано и рассчитано в разделе «Методы». Принцип также учитывает возможные риски ложного принятия или отклонения, а также желаемый уровень вероятности правильного/ложного принятия или отклонения. На основании этих соображений выводятся правила принятия решений. Кроме того, рекомендуется использовать защитные полосы при контроле качества фармацевтических средств (контроле готовой продукции) (11, 12).
Фактически решения о правильном принятии/ отклонении принимаются на основании окончательных значений, которые находятся на определенном расстоянии от пределов исходной спецификации. На рис. 1 показана общая концепция защитных полос; более подробную информацию можно получить из других источников (13). В идеале диапазон защитных полос следует выбирать равным расширенной неопределенности измерения, чтобы гарантировать достаточно низкий риск ложного принятия/отклонения. Кроме того, в зависимости от критичности истинного значения, находящегося в пределах спецификаций, защитные полосы могут быть расположены либо внутри области спецификации (область строгого принятия, см. рис. 1), либо за пределами области исходной спецификации (область менее строгого принятия) (14). Результаты в пределах области принятия приведут к выпуску фармацевтического средства;
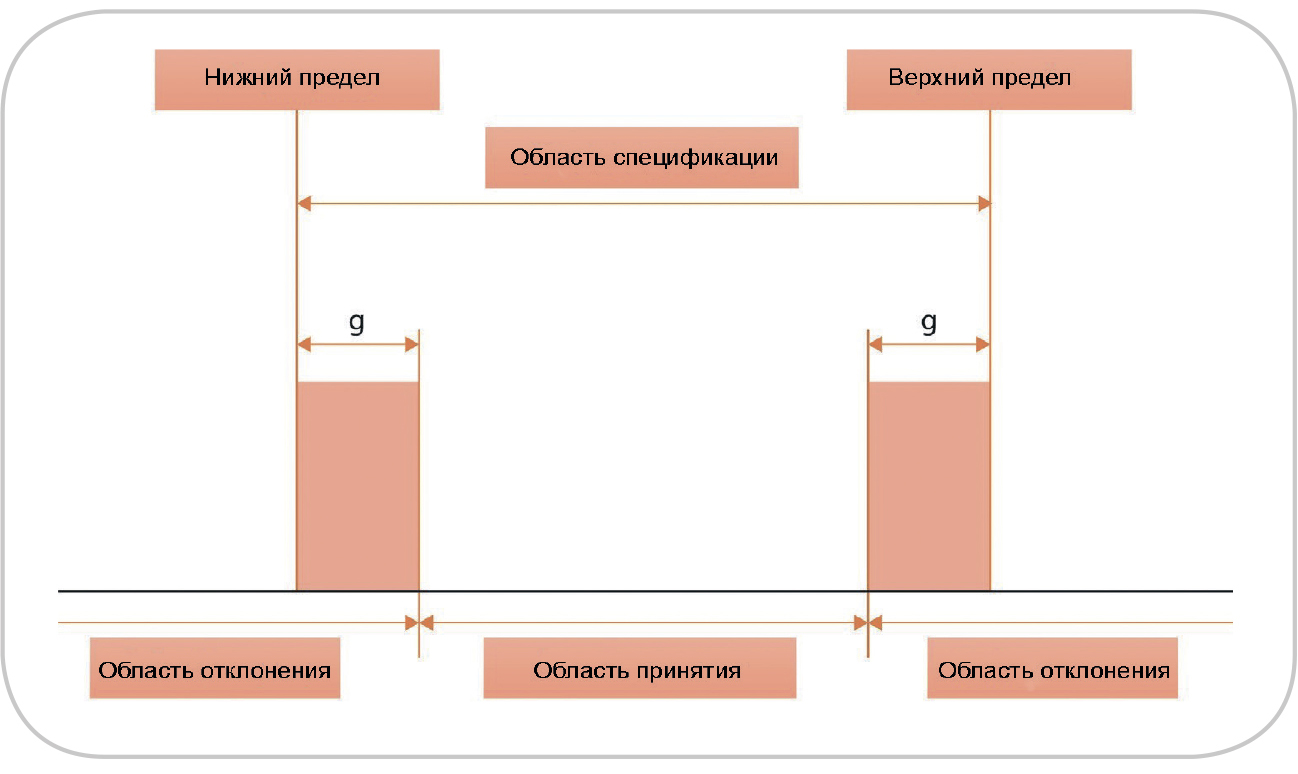
Рис. 2. Схематическое представление области принятия и отклонения
для суррогатина гидрохлорида, совместное использование нормативной
документации (НД) и фармакопейного стандартного образца (СО). Области принятия, спецификации, отклонения и защитной полосы (g) даны не в масштабе; учитывались только неопределенности для определения характеристик
первичного СО и результаты количественного анализа тестируемого вещества
результаты за пределами области принятия приведут к первоначальному отклонению. В случае первоначального отклонения можно выделить два события, используя следующие правила принятия решений, в зависимости от управления рисками лаборатории:
- Результаты в пределах защитных полос могут считаться выходящими за ожидаемые пределы (OП) и могут приводить к запуску стандартной процедуры повторного испытания OП. Это еще называется правилом принятия промежуточного решения (14);
- Результаты, выходящие за пределы, могут считаться не соответствующими спецификации и потребуют строгого расследования в соответствии со стандартной процедурой.
Защитные полосы для суррогатина HCl. В примере для суррогатина HCl расширенные неопределенности для присвоенного значения тестируемого вещества были описаны как рассчитанные в разделе «Методы»; однако в рамках фармакопейной статьи они обычно не известны пользователю и поэтому не учитываются. Такая ситуация представлена на примере фармакопейной статьи о суррогатине HCl (рис. 2), где неопределенности показаны в виде защитных полос пунктирными линиями в пределах области спецификации фармакопейной статьи. Область принятия в этом случае (т.е. при совместном использовании фармакопейной статьи в качестве нормативного документа [НД] и фармакопейного СО) будет идентична области спецификации фармакопейной статьи. Любой результат за пределами области принятия будет считаться не соответствующим спецификации. Однако на практике (здесь это не рассматривается), по всей вероятности, лаборатории допускают немного более строгую область принятия, особенно в отношении нижнего предела, так как им необходимо быть уверенными в том, что фармацевтическое средство будет соответствовать спецификации фармакопейной статьи на протяжении всего своего жизненного цикла.
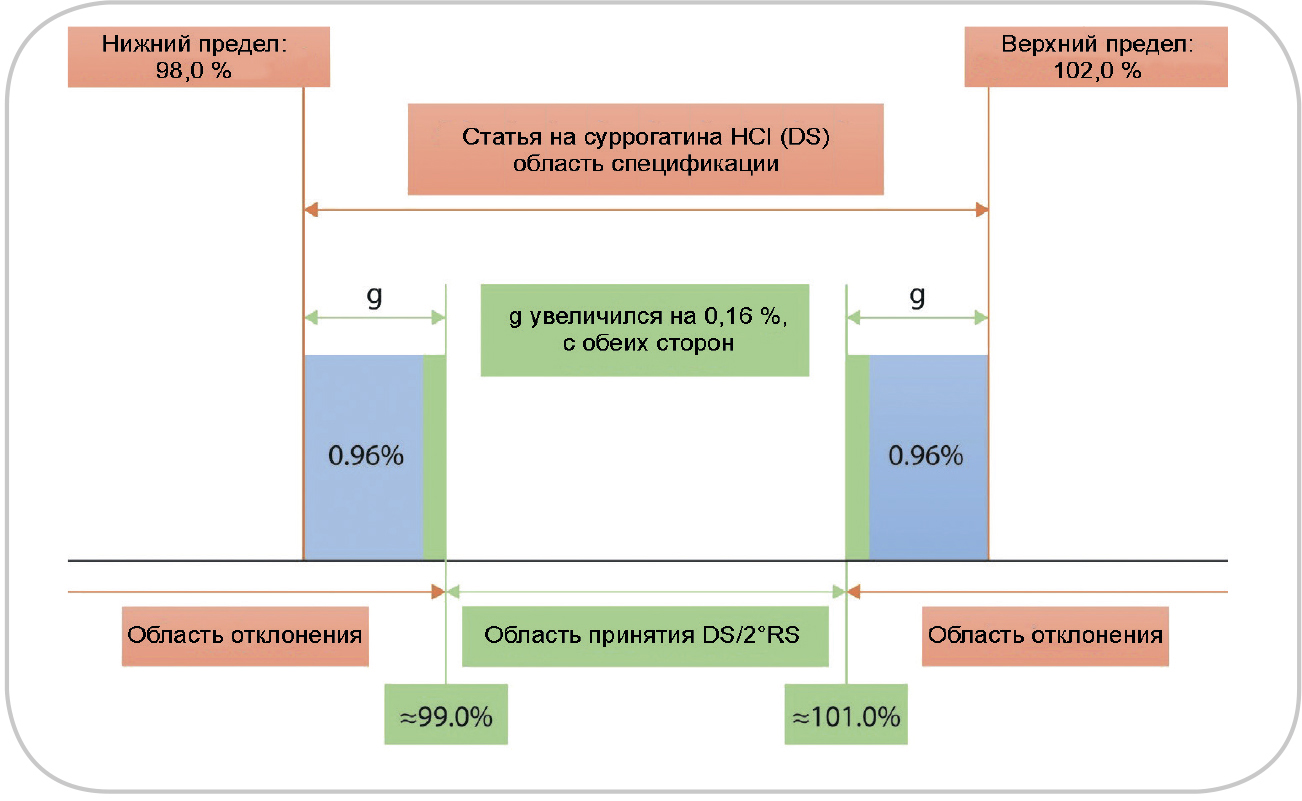
Рис. 3. Схематическое представление области принятия и отклонения
для суррогатина HCl, совместное использование нормативной документации (НД) и вторичного стандартного образца (СО) вместо фармакопейного СО.
Области принятия, спецификации, отклонения и защитной полосы (g) даны
не в масштабе; учитывались только неопределенности для определения характеристик первичного/вторичного СО и результаты количественного анализа тестируемого вещества
Защитные полосы для суррогатина HCl со вторичным СО. Сценарий изменится, если для присвоенного значения вместо фармакопейного СО будет использоваться вторичный СО (рис. 3). Добавление этого дополнительного этапа измерения приводит к большей неопределенности для вторичного СО. Следовательно, увеличивается и расширенная неопределенность для общего измерения. В результате мы имеем расширение защитной полосы (т.е. сужение области принятия). И опять такое сужение обычно не известно пользователю. Однако, согласно определению, окончательными являются только результаты, полученные с использованием оригинального фармакопейного СО; при работе с неизменившейся областью принятия существует реальный риск получить результат, не соответствующий спецификации, не осознавая этого.
Чтобы наглядно показать этот риск, была добавлена дополнительная неопределенность измерения, которая еще больше заходит в область принятия (см. рис. 3). Кроме этого, сейчас следует рассмотреть возможность использования полной защитной полосы для сужения области принятия, так как только совместное использование нормативной документации и фармакопейных СО позволяет (теоретически) получить соответствующую спецификацию и область принятия. Однако пользователь не имеет возможности рассчитать, насколько необходимо сузить область принятия.
Чтобы рассчитать расширение защитных полос для вторичного СО, кандидатное вещество для вторичного СО сначала должно занять место тестируемого вещества и иметь расширенную неопределенность 0,8% (масс. доля). Используя методы, приведенные (см. раздел «Методы») для суррогатина HCl, и принимая ОСО для этого метода равным 0,2%, результат количественного анализа вещества, протестированного с помощью вторичного СО, будет в этом случае иметь суммарную стандартную неопределенность 0,48% (масс. доля), и будет получена дополнительная составляющая 0,08% (масс. доля). В уравнении 13 для простоты количественное значение для S, вторичного СО, принималось равным количественному значению для P из уравнения 11. Защитные полосы увеличатся с 0,80 до 0,96% (масс. доля), что соответствует расширенным неопределенностям. Следовательно, область принятия должна быть сужена на 0,16% (масс. доля) с обеих сторон.
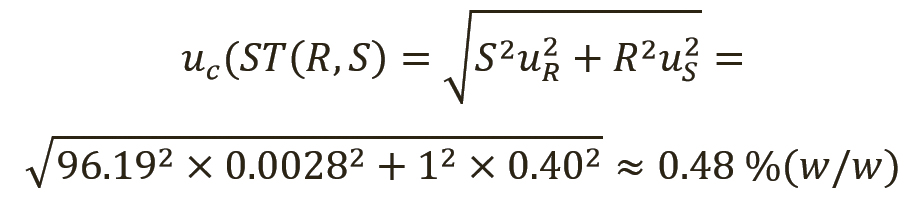
[уравн. 13]
ЗАКЛЮЧЕНИЕ
Как отмечалось в разделе «Обсуждение», можно четко увидеть значительные изменения в неопределенностях окончательных значений между фармакопейными и вторичными СО. Принцип защитной полосы наглядно иллюстрирует это. При использовании вторичного СО во время выпускающего контроля качества (КК) диапазон областей принятия/ отклонения изменится, так как использование вторичного СО вносит дополнительную неопределенность измерения.
Хотя авторы не намерены занимать позицию относительно целесообразности использования вторичных СО в некоторых обстоятельствах, необходимо учесть два важных факта.
- Присвоенные значения вторичного СО по своей природе имеют большую неопределенность измерения по сравнению с первичным (фармакопейным) СО, поскольку вводится дополнительный этап измерения (8). Следовательно, измерения, полученные с помощью вторичного СО, также имеют большую неопределенность по сравнению с измерениями с использованием соответствующего фармакопейного СО.
- Нецелесообразно применять одни и те же критерии приемки при использовании нормативного документа (фармакопейной статьи) и фармакопейного СО и при использовании вторичного СО, полученного в результате сравнения с фармакопейным СО. Фактически пользователи вторичных СО должны сузить первоначальную область принятия, чтобы гарантировать, что они по-прежнему будут находиться в пределах спецификаций фармакопейной статьи при принятии решений о приемке.
Авторы понимают, что пользователям сложно оценить влияние, которое переход с фармакопейных СО на вторичные СО окажет на критерии приемки, так как неопределенности для фармакопейных СО обычно не предоставляются по причинам, рассмотренным выше.
Для решения этой проблемы фармсообщество по контролю качества могло бы выбрать:
- работать исключительно с фармакопейными СО при установлении соответствия путем совместного использования фармакопейной документации и СО;
- установить идентичность вторичного СО по отношению к фармакопейному СО. Количественное значение и связанная с ним неопределенность измерения должны определяться независимо для вторичного СО, используя расчет баланса массы вместо количественного анализа с фармакопейным СО. Области принятия должны быть установлены с учетом полученных неопределенностей измерений. Этот подход практикуется в фармсообществе (15) по предложению экспертной комиссии ВОЗ (16). Следует сравнить результаты, полученные при использовании фармакопейного и вторичного СО; по результатам такого сравнения может быть выпущен вторичный СО. Следует предусмотреть регулярные проверки действительности такого отношения, например, при смене партии фармакопейных СО.
Статья впервые была опубликована в Pharmaceutical Technology-02-02-2021, Volume 45, Issue 2.

Контакты: ООО «Дельта Ориджин»
Телефон: +7 (495) 669 30 54
Факс: +7 (495) 204 85 32
Эл. почта: info@deltaorigin.com (секретарь), order@deltaorigin.com (запросы)
Время работы: ПН — ПТ с 9.00 до 18.00 (в ПТ до 17.00, СБ и ВС выходной)
Адрес: 129090, г. Москва, ул. Гиляровского, дом 4, строение 5, этаж 4, офис 401





