ЗАПАТЕНТОВАННЫЙ ДИЗАЙН КОНСТРУКЦИИ КАПСУЛ ДЛЯ ЖИДКОГО НАПОЛНЕНИЯ И ПРОЦЕСС ЗАПАЙКИ ДЕЛАЮТ КАПСУЛЫ LICAPS®, НЕЗАМЕТНЫМИ ДЛЯ ВСКРЫТИЯ, А ТАКЖЕ УСТОЙЧИВЫМИ К ПРОТЕЧКАМ И СЛИПАНИЮ МЕЖДУ СОБОЙ ПРИ ДЛИТЕЛЬНОМ ХРАНЕНИИ.
 Инновационные сервисы Lonza™ превращают идеи в прорывные продукты. Независимо от того, ищете ли вы свою следующую крупную идею, сталкиваетесь с технической проблемой или нуждаетесь в разработке или производственной поддержке, наши комплексные услуги по выводу готовых решений на рынок помогут вам запустить ваш следующий продукт.
Инновационные сервисы Lonza™ превращают идеи в прорывные продукты. Независимо от того, ищете ли вы свою следующую крупную идею, сталкиваетесь с технической проблемой или нуждаетесь в разработке или производственной поддержке, наши комплексные услуги по выводу готовых решений на рынок помогут вам запустить ваш следующий продукт.
Наши услуги помогут вам с:
- Дизайном продукта
- Разработкой продукта
- Производством продукции
- Дистрибуцией и логистикой
- Поддержкой после запуска
- Персонализируйте свою жидконаполненную капсулу, чтобы создать продукт, который точно соответствует вашему бренду и потребностям в разработке. Разработайте индивидуальное решение для максимальной дифференциации, узнаваемости и приверженности к бренду.
ПОПУЛЯРНЫЕ РЕШЕНИЯ ДЛЯ ИНДИВИДУАЛЬНОСТИ
Цвет
Выбирайте для своих капсул практически неограниченный выбор цветов, включая пищевые красители и варианты, не содержащие диоксида титана (TiO2)

Нанесение логотипа
Повысьте узнаваемость вашего бренда с помощью нанесения логотипа, выбирая широкий спектр пигментов (для фармацевтического и нутрицевтического применения)
- Объедините несколько ингредиентов в одной уникальной дозировочной форме.
Уникальные системы доставки ингредиентов компании Lonza и широкий выбор вариантов наполнения помогают максимально раскрыть потенциал Вашего конечного продукта, решая проблемы с рецептурой и создавая привлекательные формы для пациентов.
СИСТЕМЫ ДОСТАВКИ ИНГРЕДИЕНТОВ
 |
Технология гранул/пеллет в капсуле | • Возможность настройки профиля высвобождения –целевой или многофазный • Удобно соединять жидкие и твердые формы |
 |
DUOCAP® Технология капсула в капсуле | • Настраиваемый профиль высвобождения • Подходит для комбинированного или двойного применения с твердыми веществами и жидкими формами |
 |
Технология гранул/пеллет + капсула в капсул | • Запатентованная система доставки • Подходит для комбинированного или двойного применения с твердыми веществами и жидкими формами |
 |
Технология таблетка в капсуле | • Целевой или многофазный профиль высвобождения • Возможность легко смешивать жидкости и твердые ингредиенты большого объёма |
 |
Технология минитаблеток в капсуле | • Целевой или многофазный профиль высвобождения • Возможность легко смешивать жидкости и твердые ингредиенты большого объёма |
 |
Технология многокомпонентного смешивания липидов | • Замедленный или модифицированный профиль высвобождения с дополнительной маскировкой запаха/вкуса • Повышают биодоступность ингредиентов за счет различных размеров частиц (50-300 мкм) • Доступно для сухого и жидкого наполнением |
 |
Технология лавовых ламп
*Доступна только для стран Северной Америки |
• Возможность легко сочетать ингредиенты на масляной и водной основе • Возможность создания визуальной эстетики, подобной лавовой лампе |
ЧТО МОЖНО КАПСУЛИРОВАТЬ?
| Масла | Суспензии | Водные формы | Полутвердые формы |
 |
 |
 |
 |
| Повышают биодоступность и стабильность, содержат нативные формы липидных ингредиентов. | Возможность использования комбинации твердых веществ и жидкостей, максимизируя дозировку конечной формы | Максимальное количество растворимых активных веществ, обеспечение гигроскопичности активных веществ, повышение стабильности конечной формы | Возможность максимизировать биодоступность, стабильность и дозировку конечной формы |
АКТИВАЦИЯ РЕЦЕПТУР ПЛОХО ВСАСЫВАЕМЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ С ПОМОЩЬЮ КАПСУЛ LICAPS®
По мере того, как фармацевтическая разработка все больше движется в сторону нишевых, узкоспециализированных препаратов, разработчики рецептур часто сталкиваются с проблемой, связанной с плохо всасываемыми активными фармацевтическими ингредиентами (АФИ). Как результат, был разработан ряд пероральных лекарственных форм, в котором были преодолены проблемы с биодоступностью и всасыванием сложных рецептур лекарственных препаратов. В этой статье освещается вопрос, как рецептура на основе липидов (LBF) может помочь улучшить биодоступность, исследуется использование аморфных твердых дисперсий (ASD) для улучшения всасывания и предлагаются некоторые рекомендации по выбору капсулы, которая будет соответствовать требованиям разработки.
ТЕКУЩИЙ КОНТЕКСТ
Информация из базы данных PharmaCircle™ [1], по состоянию на апрель 2021 года, указывает на то, что из 4523 новых молекулярных единиц в процессе разработки пероральных лекарственных препаратов только 30% соответствуют критериям, которые позволяют охарактеризовать эти препараты как растворимые или имеющие низкую растворимость; для остальных подобная характеристика не указана. По мере того, как лекарственные препараты проходят этапы разработки от доклинических исследований до регистрации, количество лекарственных препаратов, где характеристика растворимости указана, – уменьшается, как и следовало ожидать, но при этом АФИ с низкой растворимостью преобладают, составляя 93–97% всех разрабатываемых лекарственных средств.
Лекарственные препараты с низкой растворимостью делятся на две категории в зависимости от их физико-химических свойств: типа кирпичной пыли, обычно имеющие высокую температуру плавления с пороговым уровнем около 200 °C; и жирные шарики – соединения, которые демонстрируют растворимость, ограниченную сольватацией, и обычно связаны с высоким коэффициентом распределения (logP), который указывает на липофильность с пороговым уровнем от 2,0 до 3,6.
Надлежащее определение критических свойств материала (CMA) лекарственных препаратов является ключом к выбору правильной технологии, позволяющей устранить причину низкой растворимости.
 ВАРИАНТЫ РЕЦЕПТУР
ВАРИАНТЫ РЕЦЕПТУР
В настоящее время существуют различные варианты достижения целевых параметров рецептур. Общие стратегии рассмотрены в справочном документе 2, а в справочных документах 3 и 4 (из списка литературы в конце статьи) представлены обзоры наиболее актуальных технологий с указанием на существующие сложности и перспективы их использования при разработке лекарственных средств (2–4).
К наиболее распространенным относятся:
- Уменьшение размера частиц для улучшения растворения в требуемой среде;
- Системы на основе липидов, растворяющие лекарственные препараты, растворимость которых ограничена сольватацией, и которые также могут оказывать действие, внося изменения в локальную среду солюбилизации желудочно-кишечного тракта (ЖКТ);
- Аморфные твердые дисперсии (ASD), в которых барьер для растворимости устраняется путем преобразования кристаллического лекарственного средства в аморфное состояние.
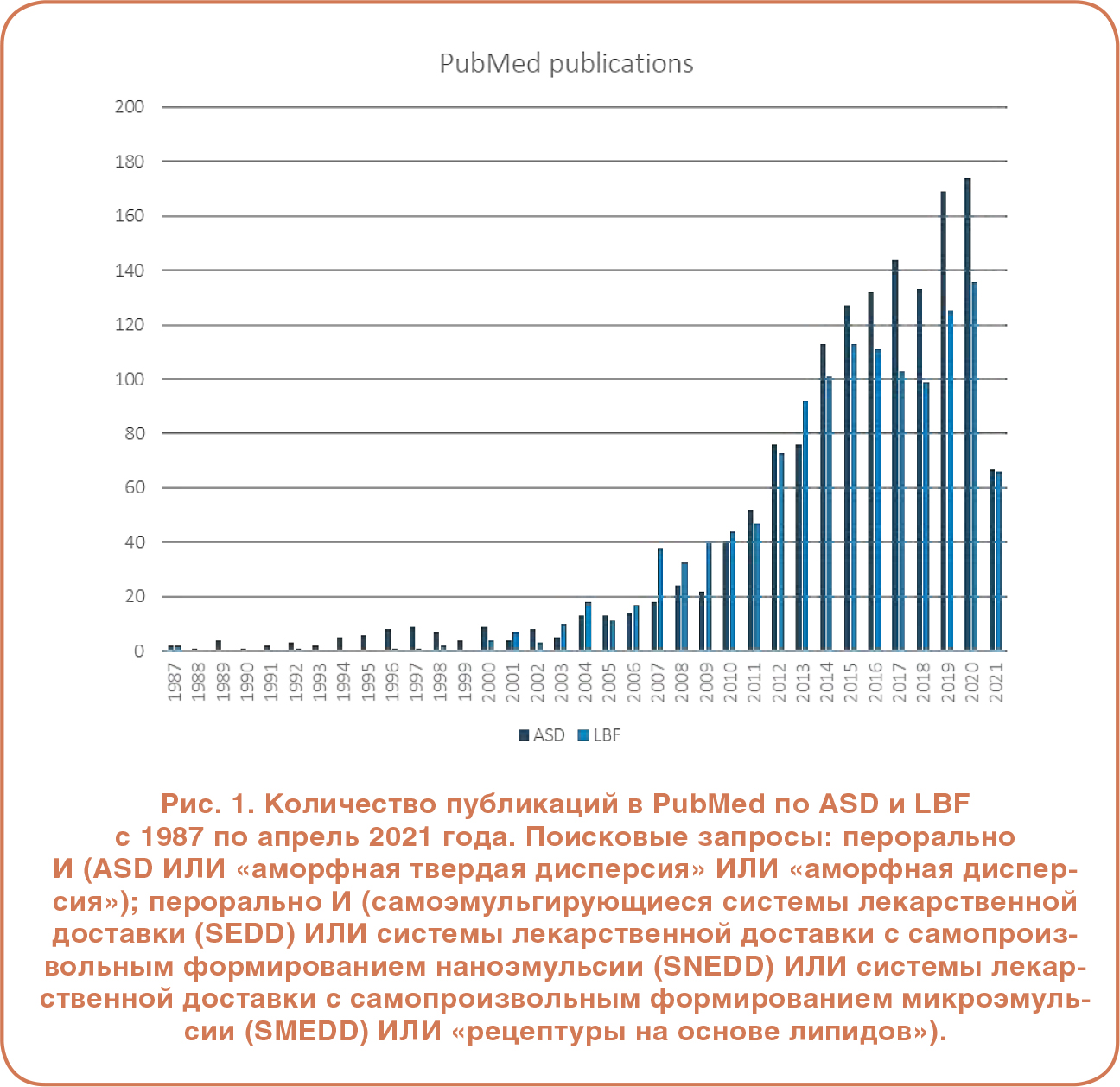
Как LBF, так и ASD широко применяются для повышения общей жизнеспособности соединений с ограниченной растворимостью. По данным PharmaCircle™, полученным в апреле 2021 года, в настоящее время в разработке находится примерно сравнимое количество проектов, в которых используются эти методы [1]. LBF и ASD не только способны увеличивать растворимость, но также могут способствовать всасыванию лекарственных средств, ингибируя некоторые функции экспорта клеток, таких как P-гликопротеин, и обеспечивая возможность проталкивания лекарственного средства через эпителий за счет перенасыщения лекарственного средства в просвете кишечника. На Рисунке 1 показано количество статей, перечисленных в PubMed по методикам LBF и ASD с 1987 по 2021 год, и показано их резкое увеличение за последнее десятилетие, что отражает текущие исследования этих методов по мере того, как ученые стремятся расширить их применение.
ИЗУЧЕНИЕ РЕЦЕПТУР НА ОСНОВЕ ЛИПИДОВ
LBF в основном представляют собой изотропные растворы лекарственного препарата в смеси жидких или полутвердых вспомогательных веществ. Большинство из них фасуют и запечатывают в твердые капсулы, что для полутвердых препаратов влечет за собой плавление и поддержание их в жидкой форме в течение всего процесса инкапсуляции. Лекарства-кандидаты в LBF обычно представляют собой жирные шарики с ограниченной растворимостью. Обычно лекарственный препарат растворяется в LBF перед инкапсуляцией, но есть исключения, когда лекарственный препарат находится в суспензии в самом липиде, который затем растворяется в ЖКТ за счет соответствующей модификации кишечных коллоидов липидом или липидным метаболитом рецептуры. Рецептуры LBF можно классифицировать, как показано в Таблице 1, в зависимости от их состава и поведения при контакте с водными жидкостями.
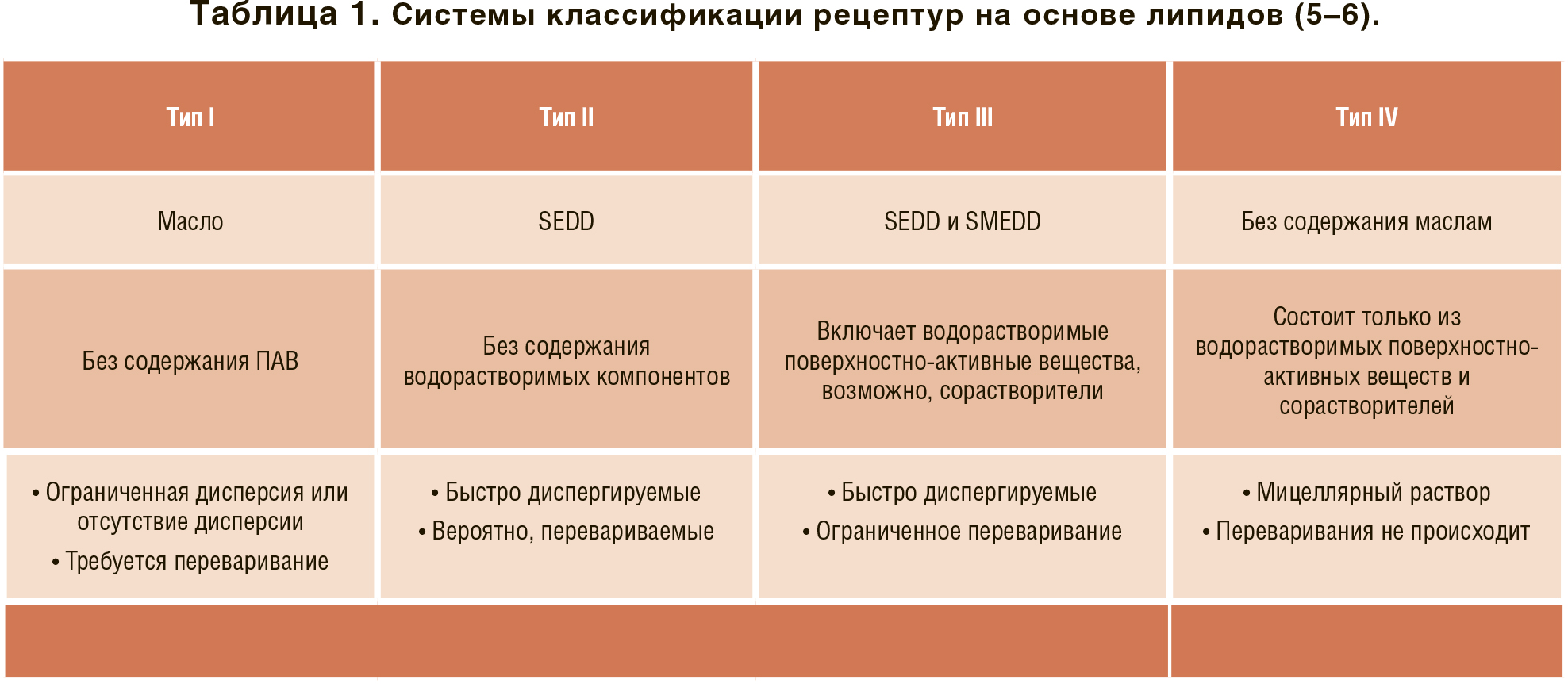
Рецептуры типа I состоят только из масел, в основном смесей моно-, ди- и триглицеридов растительного происхождения, без поверхностно-активного вещества. Эти рецептуры подходят для высоколипофильных соединений жирных шариков с высоким logP. Рецептуры типа II, также известные как самоэмульгирующиеся системы лекарственной доставки (SEDD), содержат масло, воду и растворимые поверхностно-активные вещества, они способны образовывать грубые эмульсии в водной среде. Рецептуры типа III являются более гидрофильными версиями SEDD, которые могут образовывать микро- или даже наноэмульсии при контакте с водной средой. Рецептуры типа III представляют собой более гидрофильные версии SEDD, которые могут образовывать микро-или наноэмульсии при контакте с водной средой. Они быстро образуют мицеллярные растворы при контакте с водной средой и больше подходят для менее липофильных соединений.
Основные характеристики LBF и степень их влияния на процесс всасывания:
- Поддержание солюбилизации на этапе диспергирования/переваривания в просвете желудочно-кишечного тракта;
- Способствует эффективной диффузии через слой слизи для достижения кишечного эпителия;
- Может открывать плотные соединения и способствовать парацеллюлярному захвату;
- Может подавлять пресистемный метаболизм;
- Может стимулировать секрецию хиломикронов и способствовать лимфатическому захвату.
Это делает LBF мощными инструментами для решения некоторых из наиболее сложных проблем АФИ.

ПРАКТИЧЕСКИЕ АСПЕКТЫ РАБОТЫ С LBF
Одним из наиболее заметных аспектов применения LBF является повышение биодоступности плохо растворимых в воде АФИ – категории, которая продолжает доминировать в спектре сложных фармацевтических субстанций. Самоэмульгирующиеся рецептуры и рецептуры с самопроизвольным формированием микроэмульсии использовались для решения проблем водорастворимости в ряде продаваемых на рынке лекарственных препаратов. Солюбилизация соединения в липидной матрице также предлагает эффективную стратегию для смягчения таких проблем, как достижение однородности дозы в составах с низкой дозировкой и преодоление проблем, связанных с мелкими частицами и пылью при работе с АФИ с высокой эффективностью, что снижает риски, связанные с обращением с рецептурой.
Все эти жидкие рецептуры затем требуют подходящей фасовки, которая для пероральной доставки включает технологию мягких гелевых или твердых капсул. Однако не все твердые капсулы подходят для фасовки, и для этих уникальных рецептур требуются капсулы, специально разработанные и оптимизированные для работы со средами на основе липидов. Достижения в области технологий и дизайна теперь обеспечивают решения, которые более эффективно отвечают строгим требованиям, связанным с сегодняшними LBF, и примером этого являются твердые капсулы Capsugel® Licaps® (см. Рисунок 2). Эта герметичная капсула, состоящая из двух частей, снижает вероятность протечки и вскрытия, а выбор полимеров помогает найти решение дополнительным сложностям рецептуры, такими как чувствительность АФИ к влаге, кислороду или свету. Критически важна система двойного замка, которая удерживает состав вне зоны уплотнения и обеспечивает целостность. Капсулы наполняют с использованием процесса герметизации методом жидкого капсулирования с помощью микроопрыскивания (LEMS), а фасовка и герметизация могут выполняться в различных масштабах – от лабораторного опытного изготовления с масштабированием до масштабного коммерческого производства.
 РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ
РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ
Ключевой характеристикой аморфных лекарственных препаратов является то, что они более растворимы, чем их кристаллические аналоги, что приводит к общей более высокой биодоступности. Однако главный недостаток состоит в том, что вещества в аморфном состоянии менее стабильны и имеют тенденцию возвращаться к более упорядоченной кристаллической форме. Чтобы поддерживать лекарственный препарат в аморфной форме и продлевать его стабильность с течением времени, требуется добавление полимеров, таких как гипромеллоза (гидроксипропилметилцеллюлоза или ГПМЦ) или гипромеллозы ацетата сукцинат (ГПМЦ-АС), оба из которых являются аморфными вспомогательными веществами. Затем смесь лекарственного средства и полимера обрабатывают распылительной сушкой, экструзией из горячего расплава или измельчением для преобразования кристаллического материала в аморфное состояние. Это превращение отслеживают с помощью дифференциальной сканирующей калориметрии (DSC) для проверки отсутствия пиков плавления и наличия менее интенсивного стеклования. Рентгеноструктурный анализ (XRD) подтверждает исчезновение пиковых характеристик кристаллической фазы и появление аморфного гало. Наконец, форму аморфной частицы можно исследовать с помощью сканирующей электронной микроскопии (SEM).
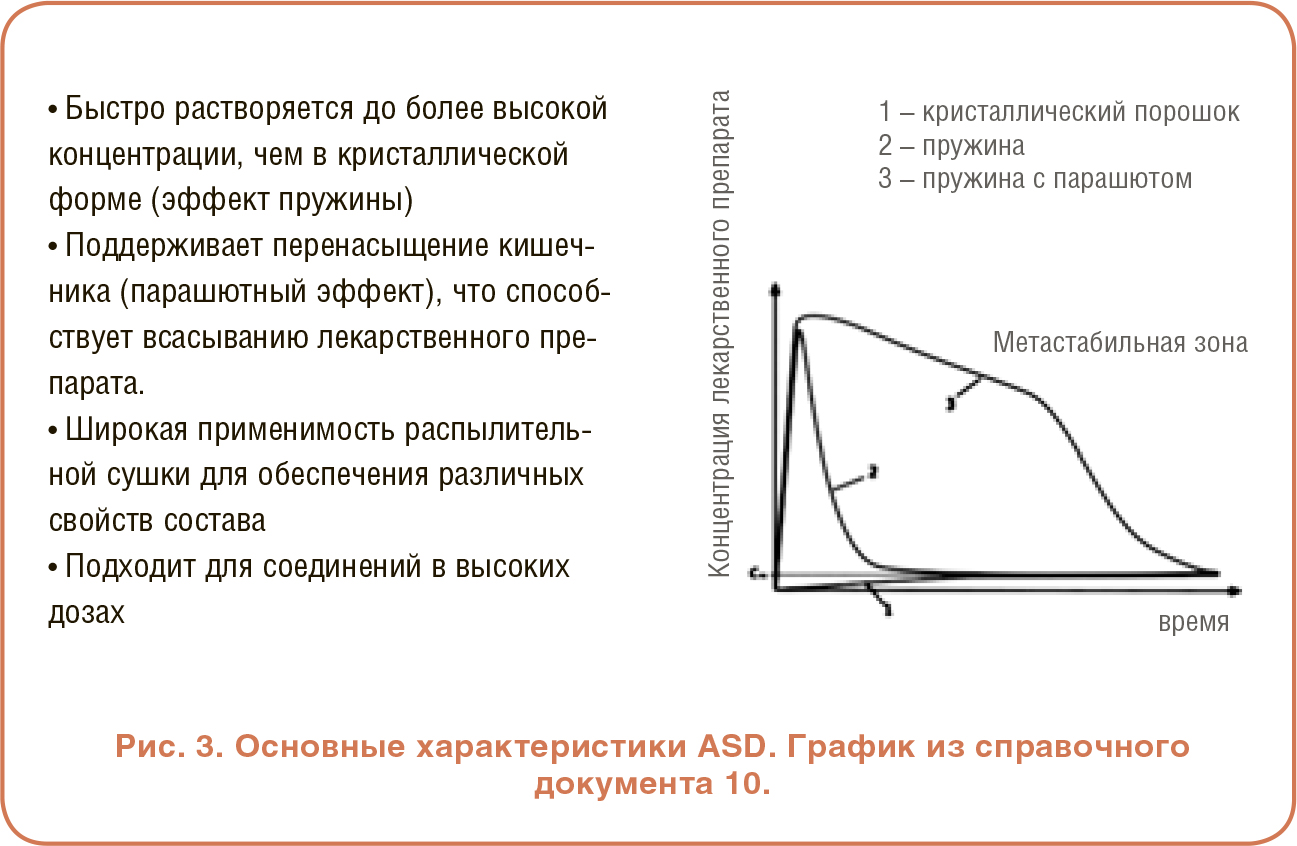
Основные характеристики ASD суммированы на Рисунке 3, где график показывает концентрацию лекарственного препарата в растворе как функцию зависимости от времени. Кривая 1 представляет собой кристаллическую форму, которая является медленной и ограниченной и, наконец, достигает равновесной растворимости лекарственного средства. Кривая 2 представляет собой ASD того же лекарственного препарата, где наблюдается быстрое и обширное растворение – эффект пружины – но также и неспособность поддерживать перенасыщение (концентрацию выше равновесной растворимости) с течением времени. Кривая 3 показывает ASD с добавлением ГПМЦ. Этот полимер представляет собой парашют, который помогает избежать кристаллизации лекарственного средства и поддерживать более длительное перенасыщение in vivo, чтобы ускорить и дать больше времени для всасывания лекарственного средства. Таким образом, кривая 3 показывает эффект пружины с быстрым и обширным растворением лекарственного средства, но, в отличие от кривой 2, также присутствует парашютный эффект. Эффекты пружины и парашюта описаны во многих публикациях, одним из примеров которых является справочный документ 10, и хорошо объяснены в недавнем видео на YouTube [11].
Еще одной важной характеристикой ASD является их пригодность для производства с помощью распылительной сушки, которая имеет широкое применение для различных соединений, просто регулируя полимер, растворитель или условия обработки. Наконец, одним из основных преимуществ ASD является возможность использовать этот метод с высокими дозами соединений.
 УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
Некоторые соединения, в основном слабоосновные молекулы, обладают высокой растворимостью при низком pH в желудочной среде, но быстро кристаллизуются при более высоком pH в кишечнике. Известно, что ГПМЦ ингибирует эти взаимодействия. Растворяясь с активной рецептурой, она способствует перенасыщению и снижает количество действующего вещества, которое кристаллизуется при более высоком pH. ГПМЦ использовалась в качестве добавки в составе ASD для решения аналогичных проблем, и было предложено, что включение этого полимера в саму оболочку капсулы может улучшить характеристики солюбилизации таким образом, чтобы оставить больше места в капсуле для улучшения загрузки лекарственного средства.
Экспериментальная работа с использованием эрлотиниба, слабоосновной молекулы, которая примерно вдвое меньше растворима в моделированной кишечной жидкости, чем в моделированной желудочной жидкости, демонстрирует концепцию поддержания растворимости в кишечном pH. Высушенные распылением рецептуры препаратов Эрлотиниб и Eudragit® L100 SDD (функциональный полимер с замедленным высвобождением) загружали как в твердые желатиновые, так и в капсулы из ГПМЦ без гелеобразующих систем. Обе инкапсулированные формы затем подвергали двухэтапному протоколу тестирования, при котором их сначала подвергали воздействию кислой, а затем кишечной среды pH. Слабоосновные молекулы обычно переходят от низкого к высокому pH с падением растворимости. Однако капсула ГПМЦ значительно улучшила растворимость по сравнению с продуктом в желатиновой капсуле, при этом концентрация эрлотиниба примерно в два раза выше. Это показало, что ГПМЦ не только может использоваться для увеличения растворимости слабоосновных молекул, но и что капсула ГПМЦ действует в этом случае как функциональный наполнитель и не обязательно должна находиться в составе, чтобы вызвать этот эффект.
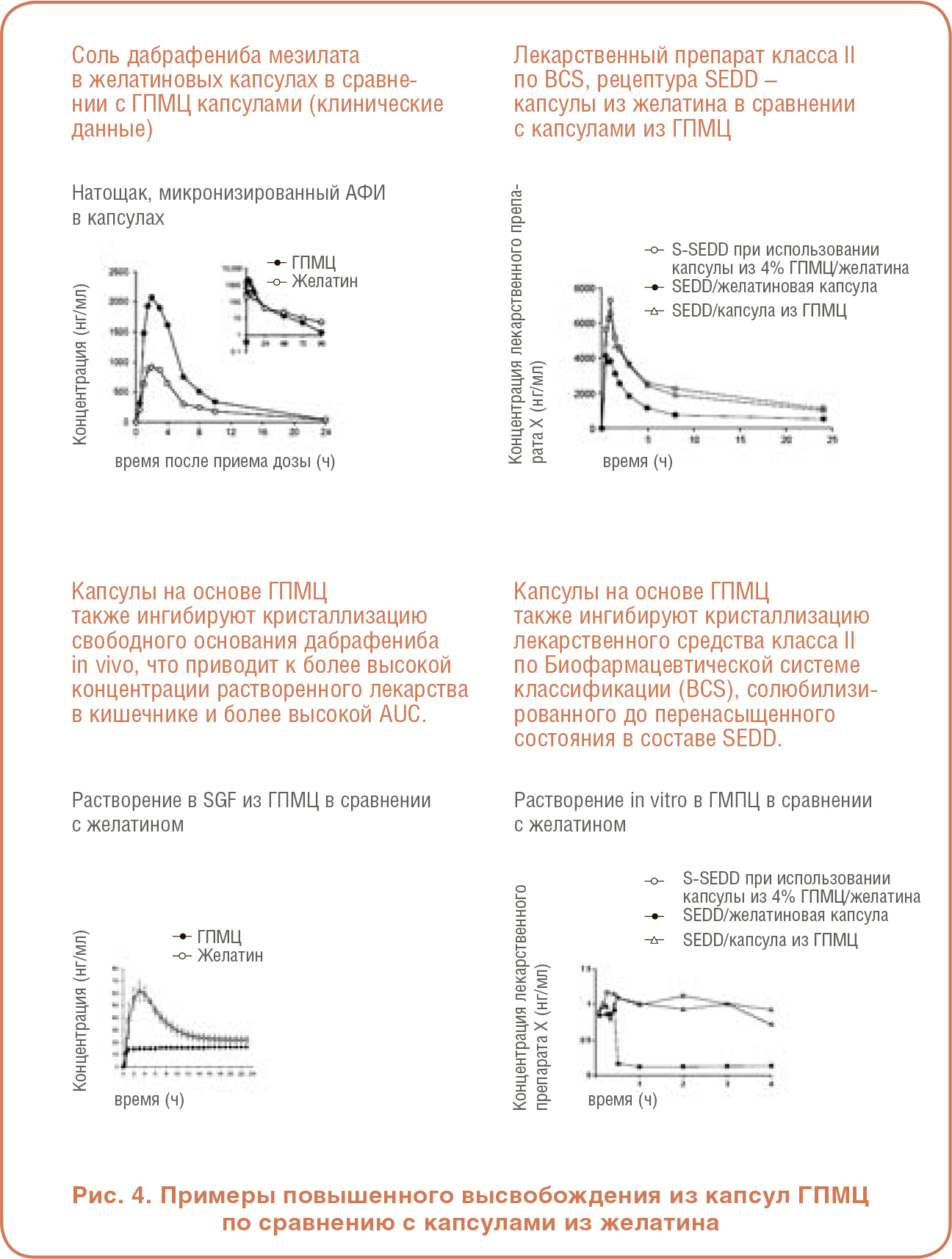
На Рисунке 4 представлены дополнительные примеры увеличения воздействия лекарственного средства при использовании капсул из ГПМЦ по сравнению с желатином. Вверху слева представлен график, показывающий постоянно более высокую концентрацию дабрафениба мезилата в крови в течение 24-часового периода у пациентов, получавших препараты, инкапсулированные в ГПМЦ, по сравнению с теми же препаратами в желатиновых капсулах. Аналогичным образом, результаты растворения в нижнем левом углу показывают, что концентрация растворенного дабрафениба в капсуле ГПМЦ значительно превышает концентрацию препарата в желатиновой капсуле. Графики в правой части Рисунка 4 показывают такую же картину результатов аналогичного исследования специальной рецептуры SEDD. Это приводит к выводу, что перенасыщение может быть достигнуто без быстрой кристаллизации как в рецептурах на основе липидов, так и в аморфных твердых дисперсионных рецептурах, и что ГПМЦ, присутствующая в капсуле, участвует в этом эффекте.
ПРИМЕРЫ ВЫБОРА КАПСУЛ
Поскольку капсула выступает в качестве функционального вспомогательного вещества, выбор капсулы становится особенно важным. Важно не иметь гелеобразующую систему в ГПМЦ, чтобы она работала с эквивалентом капсул из желатина in vivo с немедленным высвобождением. Необходимы хорошие характеристики растворения независимо от pH и ионной силы среды.
У ГПМЦ есть дополнительное преимущество, заключающееся в предотвращении сшивания, которое является риском в случае желатина, когда полимеры используются для производства ASD, а также она лучше способна контролировать чувствительность к влаге, которая может возникать как с ASD, так и с LBF. Кроме того, как полимер на растительной основе, ГПМЦ является широко применимым одобренным компонентом.
ЗАКЛЮЧЕНИЕ
Обеспечение необходимой биодоступности низкорастворимых АФИ – это постоянная проблема фармацевтических исследований и разработок, которая ставит перед разработчиками рецептур множество задач. Для поиска решения часто используются две стратегии: разработка рецептуры на основе липидов или аморфной твердой дисперсии. Оба подхода предполагают инкапсуляцию в твердой лекарственной форме для перорального применения. Как рецептура, так и капсула играют важную роль в преодолении проблемы биодоступности и повышении всасывания плохо усваиваемых АФИ. Данная современная технология позволяет получать капсулы, которые сами по себе выступают в качестве функциональных вспомогательных веществ, и правильный выбор капсулы для сложной рецептуры имеет решающее значение для успеха.
 КОНТАКТЫ:
КОНТАКТЫ:
Представительство в России: «ООО Капсугель»
142000, Московская область г. Домодедово, ул. Логистическая д. 1/6
Телефон: +7(495)795-37-77
E-mail: ru@lonza.com
Web: www.capsugel.ru





