Автор: Елена Зелинская, уполномоченное лицо ООО «ФАРМА КАПИТАЛ»
Аттестация Уполномоченных лиц по ЕАЭС идет полным ходом, но что делать, если человек сменил работу?
1-й этап:
В соответствии с п. 29 Приказа Минздрава России от 12.01.2021 № 7н «Об утверждении перечня документов, представляемых аттестуемым УЛ производителя ЛС государства – члена ЕАЭС, этапов процедуры и порядка принятия решений об аттестации УЛ производителей ЛС для медицинского применения в соответствии с Порядком аттестации УЛ производителей ЛС, утвержденным решением Совета ЕЭК от 3 ноября 2016 г. № 73 ‘‘О Порядке аттестации УЛ производителей лекарственных средств’’»
«В случае изменения места работы или прекращения профессиональной деятельности УЛ размещает в личном кабинете уведомление с указанием измененных сведений о занимаемой должности и (или) месте работы: полное и сокращенное наименования юридического лица согласно учредительному документу с указанием организационно-правовой формы и уникального идентификатора юридического лица в реестре юридических лиц, адрес осуществления деятельности юридического лица, контактные сведения: номера телефона и факса, адрес электронной почты (при наличии) юридического лица или дату прекращения своей профессиональной деятельности в качестве УЛ».
На сайте https://grls.rosminzdrav.ru/ в разделе справки размещена «Инструкция по загрузке уведомлений с указанием измененных сведений о занимаемой должности и (или) месте работы (ЕЭК)» в которой указано, что размещение уведомления в личном кабинете осуществляется путем размещения электронной версии Уведомления в разделе «Прочее» досье заявления об аттестации УЛ. (Рис. 1).
Для выполнения данной инструкции необходимо зай-ти в свое заявление в личном кабинете: «ЕЭК-Заявление на аттестацию УЛ» – «Найти» – Заходите в свое заявление – «Досье» – «Прочее» (Рис. 2).
Уведомление пишется на имя директора Департамента регулирования обращения лекарственных средств и медицинских изделий в свободной форме с указанием информации, перечисленной в п. 29 Приказа Минздрава России от 12.01.2021 № 7н. Можно подгрузить скан документа, оформленный на фирменном бланке организации.
В нормативных документах отсутствует информация о необходимости направления оригинала документа. Но желательно обратить внимание регулятора на внесенные изменения в личном кабинете и продублировать Уведомление заказным письмом или отвезти его в Минздрав в Экспедицию. В любом случае советуем оставить себе один экземпляр документа и доказательства отправки документа в Минздрав (отметка экспедиции, заказ оформления курьеру).
Могут возникнуть технические проблемы с загрузкой документа. Одна из таких причин – это отсутствие аттестованного Уполномоченного лица в реестре УЛ и/или неправильный статус заявления.
|
Рис.1 Инструкция по размещению в личном кабинете уведомления об изменении места работы или прекращения профессиональной деятельности Инструкция по размещению в личном кабинете уведомления об изменении места работы или прекращения профессиональной деятельности |
Наличие аттестованного Уполномоченного лица на фармацевтическом заводе – одно из основных лицензионных требований. Но наличие Приказа Минздрава об аттестации – не единственное лицензионное требование к УЛ. С точки зрения Постановления Правительства РФ от 06.07.2012 № 686 «Об утверждении Положения о лицензировании производства лекарственных средств», Уполномоченное лицо должно быть включено в реестр УЛ производителей ЛС ЕАЭС.
Реестр находится на https:// grls.rosminzdrav.ru. С внесением в реестр у части коллег почему-то возникают проблемы. Аттестация есть, а в реестре Уполномоченное лицо отсутствует. Внизу сайта есть контакты технической поддержки, но, к сожалению, они не отвечают за внесение информации в реестр. Информацию не может добавить ваша Аттестационная комиссия. За реестр отвечает Министерство здравоохранения. При обнаружении отсутствия аттестованного Уполномоченного лица, необходимо обращаться в Министерство здравоохранения. Обращение пишется на имя директора Департамента регулирования обращения лекарственных средств и медицинских изделий в свободной форме, его можно отправить как в бумажном, через Экспедицию, так и в электронном виде.
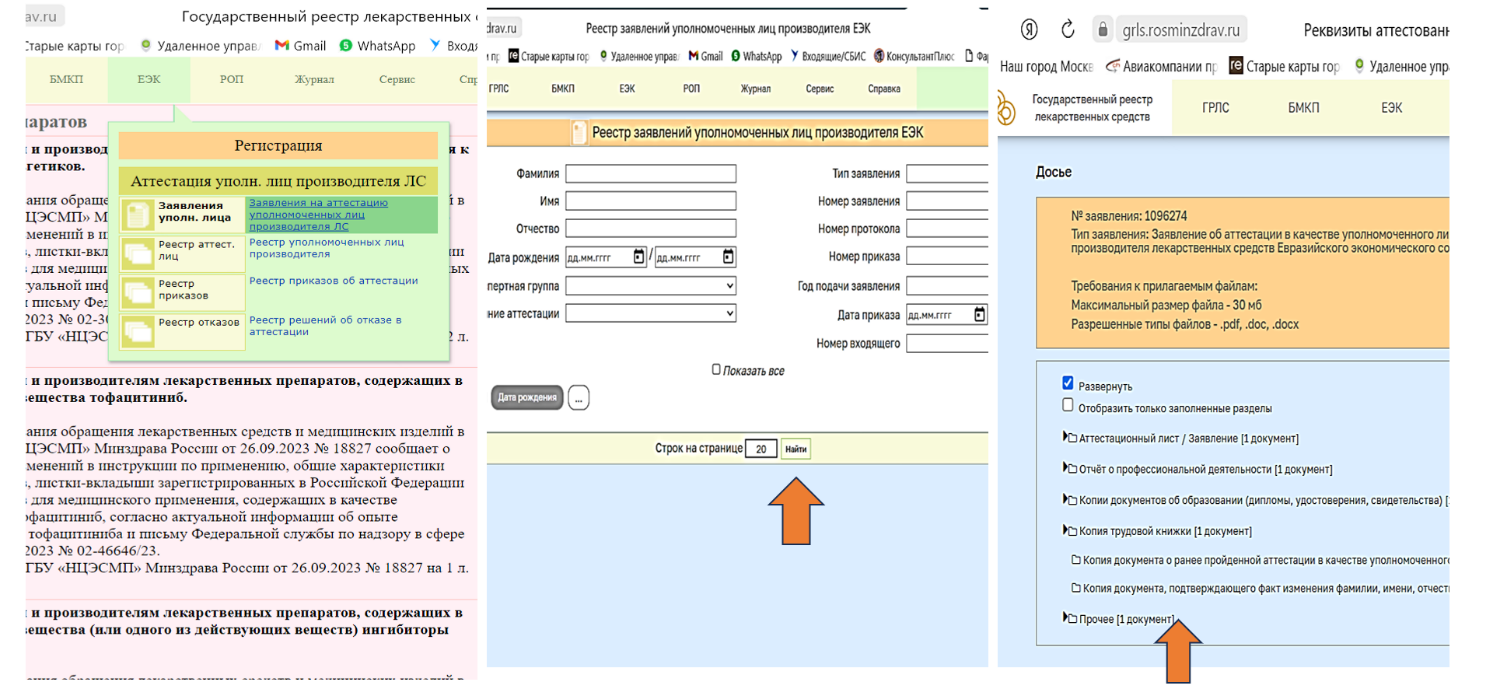
Рис. 2. Путь следования до раздела «Прочее»
2-й этап
В соответствии с п. 14 Решения Совета ЕЭК от 03.11.2016 № 74 «Об утверждении Порядка формирования и ведения реестра УЛ производителей ЛС ЕАЭС»: «В случае изменения места работы уполномоченного лица на территории одного государства-члена на новое место работы, находящееся на территории другого государства-члена, соответствующие измененные сведения на основании письменного обращения уполномоченного лица передаются в Комиссию уполномоченным органом того государства-члена, на территории которого находилось предыдущее место работы уполномоченного лица».
Из данного пункта можно сделать вывод, что на ос-новании уведомления УЛ одно государство – член ЕАЭС передает информацию другому. Интересно, что если посмотреть требования к уполномоченному лицу на сайтах по поиску работы, то в требованиях к кандидату работодатели указывают наличие Аттестации того государства, в котором находится работодатель, хотя это необязательно. Если человек прошел аттестацию в РФ и готов к переезду в Беларусь и прошел по компетенциям, то с точки зрения легитимности работы в качестве УЛ в другом государстве – члене ЕАЭС не должно быть юридических проблем.
3-й этап
В соответствии с п. 5 Постановления Правительства РФ от 06.07.2012 № 686 «Об утверждении Положения о лицензировании производства лекарственных средств»: «При назначении нового УЛ производителя ЛС лицензиат обязан в течение 10 рабочих дней уведомить лицензирующий орган о фамилии, имени и отчестве (при наличии) уполномоченного лица и дате его назначения».
Уведомление пишется на имя директора Департамента развития фармацевтической и медицинской промышленности Минпромторга России в свободной форме с указанием информации в соответствии с п. 5 Постановления Правительства РФ от 06.07.2012 № 686. Так как информацию подает юридическое лицо, то логичней оформить уведомление на фирменном бланке организации. В нормативных документах отсутствует информация о методах уведомления. Можно направить:
- по электронной почте;
- заказным письмом;
- отвезти в Экспедицию Минпромторга России.
Советуем оставить себе один экземпляр документа и доказательства отправки документа регулятору (отметка экспедиции, заказ оформления курьеру, ответ по эл. почте).





