Автор: ИРИНА КРАСНОВА, заместитель директора департамента развития производства и регистрации OOO «НПФ «Материа Медика Холдинг».
Возможность производства лекарственного препарата может быть ограничена текущими регистрационными мероприятиями. Среди последних такими ограничивающими факторами выступают процессы перерегистрации и внесения изменений в регистрационные досье на их финальном этапе. Учитывая, что они весьма продолжительны1, а также тот факт, что досье любого лекарственного препарата необходимо актуализировать на протяжении его жизненного цикла, при планировании производства постоянно встают вопросы:
МОЖНО ПРОИЗВОДИТЬ? ПО КАКИМ ДОКУМЕНТАМ?
На первый взгляд, ситуация довольно простая и решение, казалось бы, очевидно. Однако на практике большинство случаев можно описать следующей цитатой2: «Если бы это было так, это бы еще ничего. Если бы, конечно, оно так и было. Но так как это не так, так оно и не этак. Такова логика вещей».
По результатам анализа различных ситуаций и нормативно-правовых актов в сфере обращения лекарственных средств, составлены представленные в статье алгоритмы, которые позволят ответить на вопрос о возможности производства и ввоза (если мы говорим про экспорт) лекарственных препаратов в подавляющем большинстве случаев.
Когда регистрационное мероприятие завершено, в зависимости от наличия или отсутствия переходного периода для производства, ситуация может развиваться по двум возможным сценариям. На данном этапе будем считать, что для обоих сценариев значение переменной «переходный период для поставок» >0 дней.
СЦЕНАРИЙ № 1: Переходный период для производства предусмотрен
Если по завершении3 регистрационного мероприятия вновь утвержденные документы получены, но при этом действуют ранее утвержденные документы, существует возможность выбора пакета документов для производства (рис. 1). В частности, возможно производство лекарственного препарата по ранее утвержденным документам до истечения переходного периода (вариант 1) или производство лекарственного препарата по новым документам с даты их утверждения без ограничения по времени (вариант 2) соответственно.
Выбор документов для производства осуществляется по результатам анализа совокупности следующих факторов: запас упаковочных материалов в соответствии с ранее утвержденными документами, необходимость выполнения дополнительных мероприятий перед вводом вновь утвержденных документов и т.д.
Ситуация принимает нелинейный характер, если по завершении регистрационного мероприятия вновь утвержденные документы не получены и/или ранее утвержденные документы утратили силу (на основании срока действия, указанного на них).
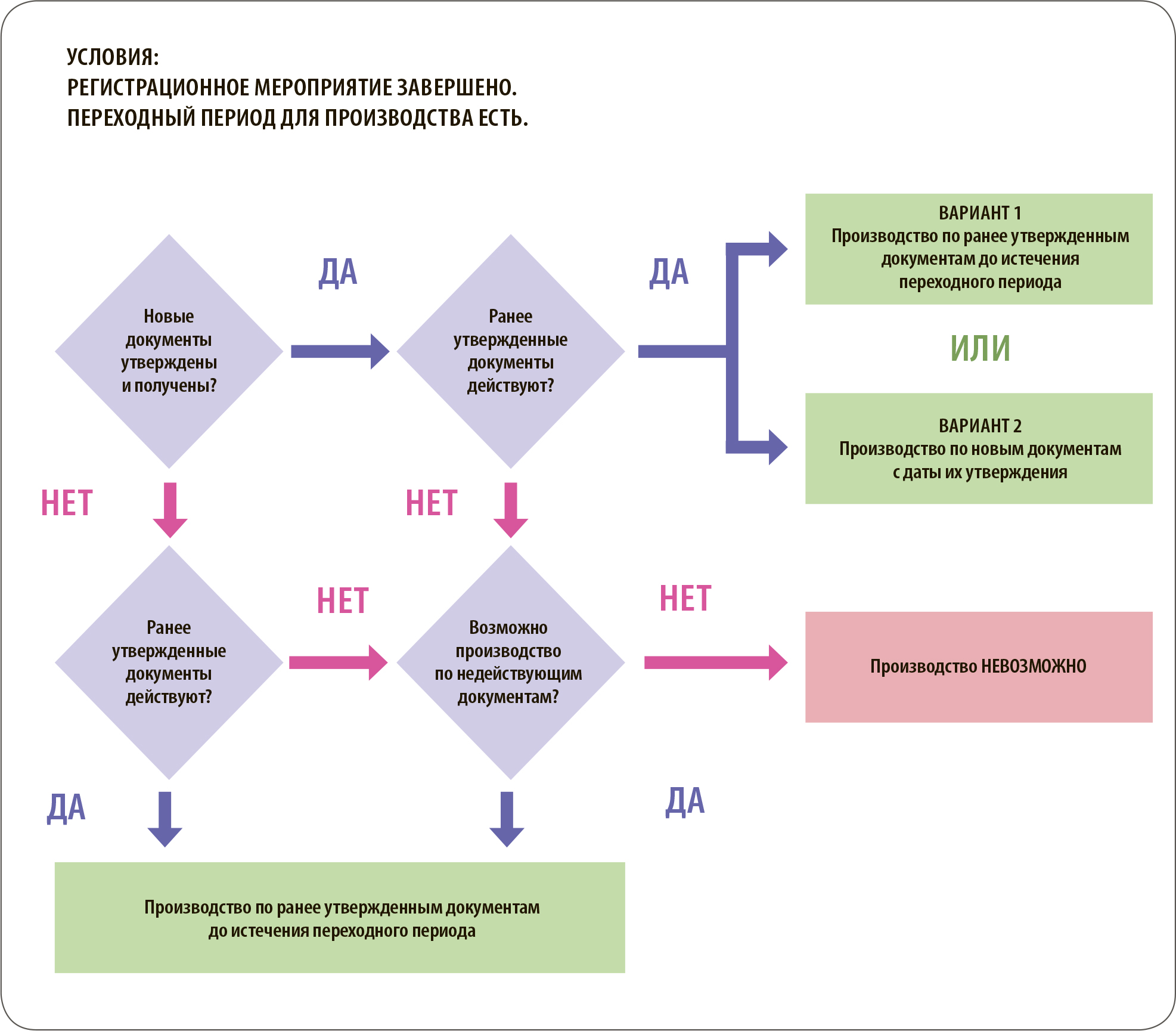
Рисунок 1. Алгоритм принятия решений о возможности производства лекарственного препарата при наличии переходного периода для производства.
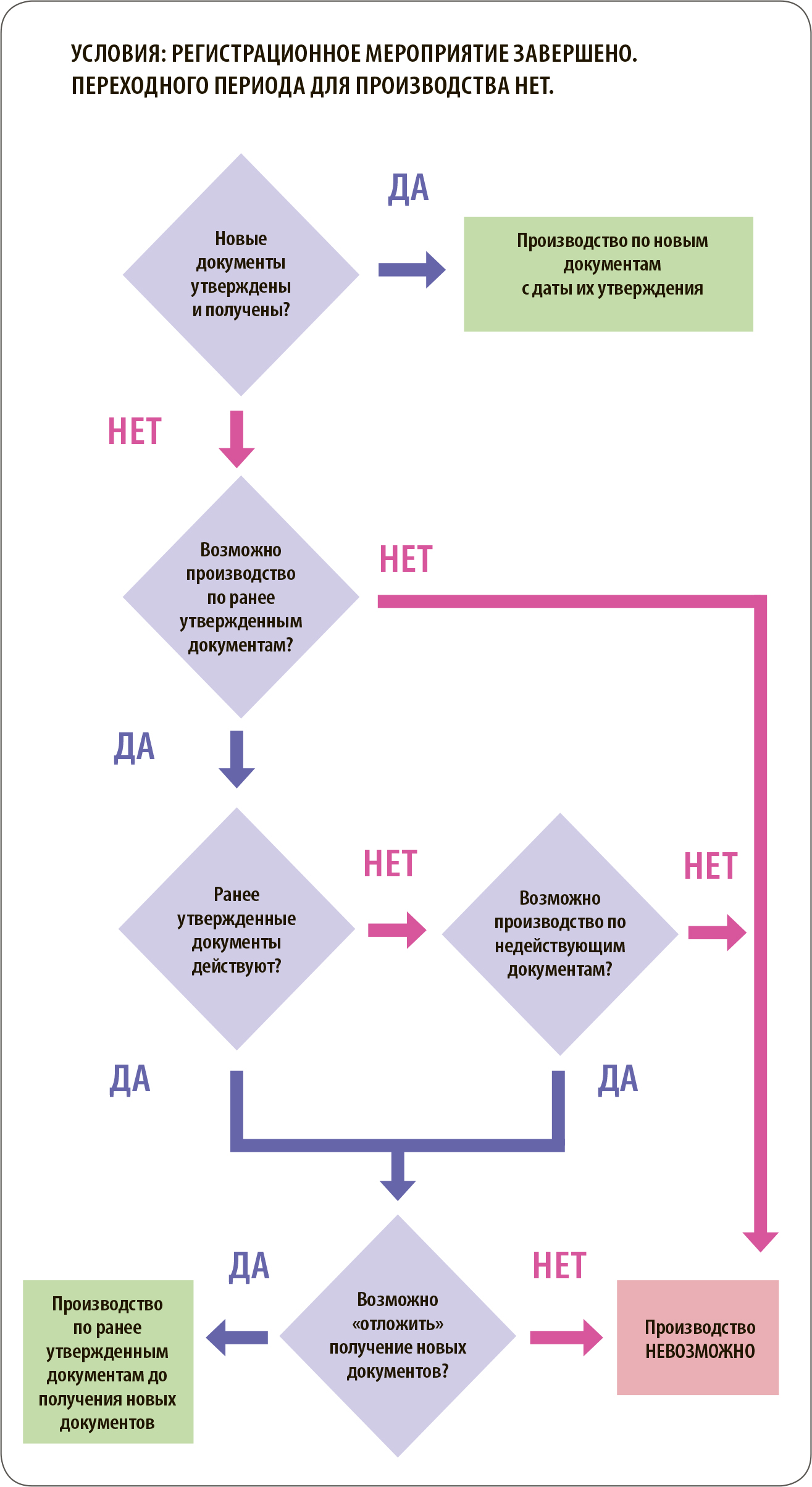
Рисунок 2. Алгоритм принятия решений о возможности производства лекарственного препарата при отсутствии переходного периода для производства.
Если по завершении регистрационного мероприятия вновь утвержденные документы не получены и ранее утвержденные документы действуют, возможно производство лекарственного препарата по ранее утвержденным документам.
Если по завершении регистрационного мероприятия вновь утвержденные документы не получены и ранее утвержденные документы утратили силу, но существует возможность производить по недействующим документам4, возможно производство по ранее утвержденным документам.
Например, в Мексике возможно производство после истечения срока регистрационного удостоверения до окончания переходного периода.
Если возможность производить по недействующим документам законодательно не предусмотрена, производство невозможно до получения новых документов.
Одним из примеров является Республика Кыргызстан, где при истечении срока регистрационного удостоверения лекарственный препарат исключается из Государственного реестра зарегистрированных ЛС, поэтому он не может быть ввезен на территорию Республики Кыргызстан. Таким образом, если ранее выданное регистрационное удостоверение утратило силу до завершения перерегистрации5, то производство и ввоз лекарственных препаратов в ранее утвержденных упаковках и с инструкцией по медицинскому применению возможны в течение 180 календарных дней с даты подтверждения регистрации, то есть после получения новых документов (прежде всего регистрационного удостоверения).
СЦЕНАРИЙ № 2: Переходный период для производства не предусмотрен
Если по завершении регистрационного мероприятия вновь утвержденные документы получены, то ранее утвержденные документы, вне зависимости от срока, указанного на них, утрачивают свое действие и производство возможно только в соответствии с новыми документами.
Однако в некоторых странах, например в Республике Армения, существует возможность получения разрешения на однократный ввоз в упаковке, не соответствующей утвержденной, что, в свою очередь, позволяет произвести и ввезти в страну одну или несколько серий лекарственного препарата, произведенных в соответствии с ранее утвержденными документами после утверждения новых документов.
Если по завершении регистрационного мероприятия новые документы не получены и/или ранее утвержденные документы утратили силу, то возможность производства лекарственного препарата зависит от следующих факторов:
- возможность переносить срок получения новых документов на более поздний период;
- возможность выпуска лекарственного препарата по недействующим документам.
В зависимости от комбинации значений вышеуказанных факторов, решение может быть различным. Если по завершении регистрационного мероприятия новые документы не получены и ранее утвержденные документы действуют, то решающим фактором для принятия решения о возможности производства станет наличие или отсутствие такой опции, как возможность перенести срок получения новых документов на более поздний период. Если такая опция предусмотрена законодательством, то до получения новых документов возможно производство лекарственного препарата по ранее утвержденным документам. Например, такая возможность предусмотрена законодательствами Азербайджана и Казахстана, что предоставляет определенную степень свободы в планировании товарных запасов.
Аналогичным образом строится логика суждений в ситуации, когда по завершении регистрационного мероприятия новые документы не получены и ранее утвержденные документы не действуют. При условии, что законодательство допускает производство по недействующим документам и существует возможность перенести срок получения новых документов на более поздний период, возможно производство лекарственного препарата по ранее утвержденным документам.
Например, в Молдове в рамках перерегистрации возможно производство после истечения срока регистрационного удостоверения.
В свою очередь, если возможность переносить срок получения утвержденных в рамках регистрационного мероприятия документов отсутствует вне зависимости от статуса ранее утвержденных документов, производство лекарственного препарата невозможно до получения новых документов.
Крайне важно, в целях сохранения GХP-соответствия во всех случаях, когда утвержденные документы утратили силу, своевременно «продлевать» срок их действия в рамках соответствующих процессов ФСК.
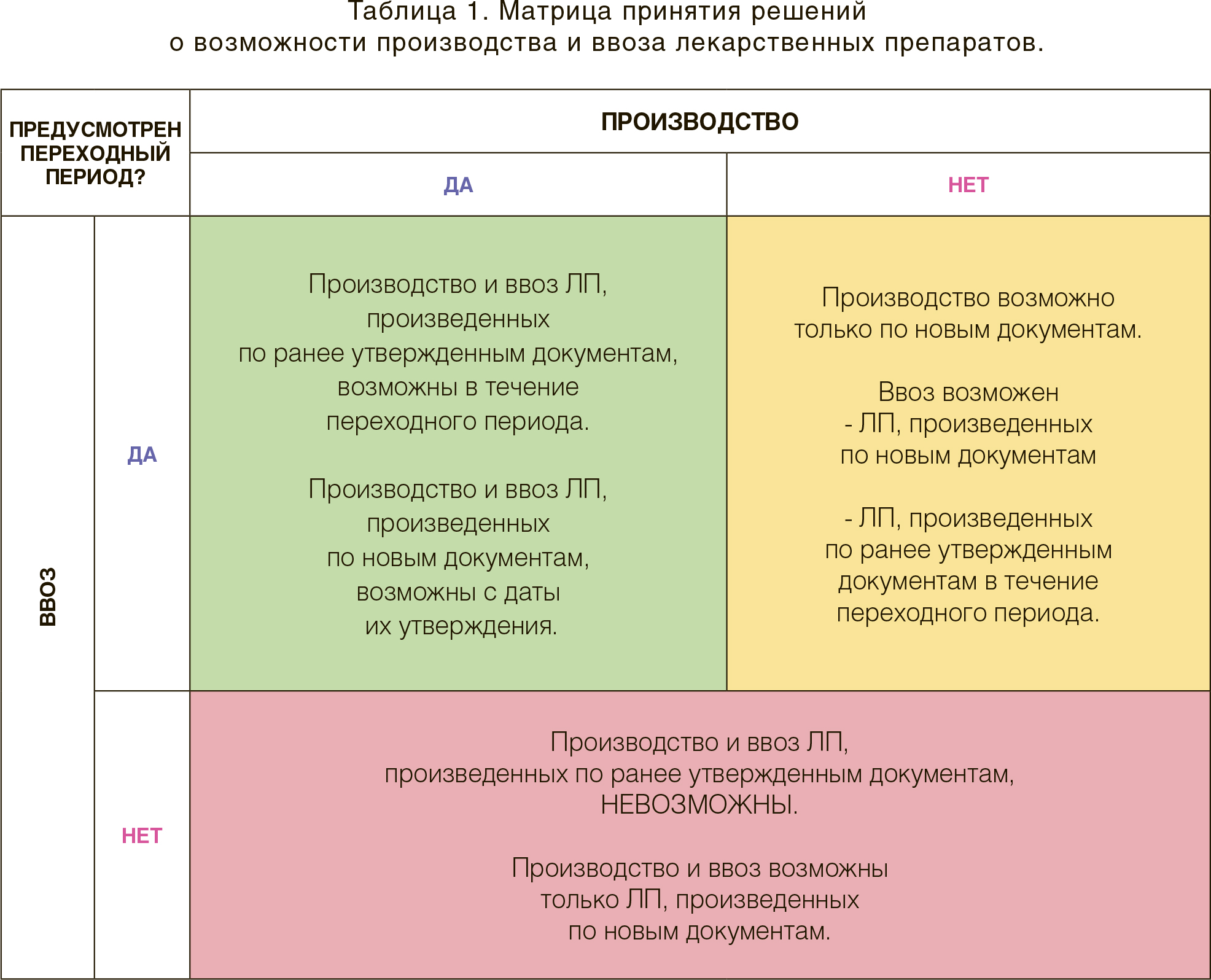
Помимо наличия или отсутствия переходного периода для производства, при планировании производства лекарственного препарата следует учитывать, предусмотрен ли переходный период для ввоза лекарственного препарата, произведенного в соответствии с ранее утвержденными документами. Во всех рассмотренных ситуациях считалось, что переходный период для поставок предусмотрен. Рассмотрим ситуации, когда «переменная» – «переходный период для поставок» – равна 0. Данная задача решается с меньшим количеством «действий», поскольку, если законодательно предусмотрен переходный период для производства, то он предусмотрен и для ввоза (таблица 1).
При этом важно не забывать, что переходный период для ввоза ограничен во времени, соответственно, необходимо спланировать производство таким образом, чтобы сохранялся достаточный временной люфт для ввоза произведенных серий. Несмотря на кажущуюся очевидность этого, вследствие неоптимальных кросс-функциональных коммуникаций возникают ситуации, когда лекарственный препарат не может быть поставлен на рынок, для которого он произведен.
 Однако в ряде стран (например, Казахстан) предусмотрен переходный период только для ввоза, но не предусмотрен для производства.
Однако в ряде стран (например, Казахстан) предусмотрен переходный период только для ввоза, но не предусмотрен для производства.
Таким образом, статус регистрационного мероприятия имеет критическое значение для планирования как производства, так и поставок. Важнейшую роль в процессах планирования производства и поставок лекарственных средств играет риск-ориентированное мышление и GXP-менталитет персонала. Внедрение риск-ориентированного подхода в процессы является одним из важнейших инструментов, который позволяет сделать процессы эффективнее, минимизировать риски человеческих ошибок, улучшить уровень целостности данных и отслеживать тенденции для своевременной корректировки стратегии развития.
В качестве «послесловия» хочу дать ответы на часто задаваемые вопросы, которые напрямую связаны с этой темой.
Вопрос 1:
Возможно ли при производстве лекарственного препарата переходить с ранее утвержденных документов на новые несколько раз в рамках переходного периода?
Ответ: Теоретически допустимо, поскольку такой вариант не противоречит нормативно-правовым актам. Однако практически он сопряжен с большими трудо-временными затратами службы качества, поскольку при его реализации необходимо вводить и аннулировать документы в рамках контроля изменений, проводя оценку риска для качества и выполняя соответствующие планы мероприятий. В связи с этим целесообразно оценить совокупную выгоду. В большинстве случаев проще списать упаковочные материалы и инструкции, чем пересматривать документы по качеству (спецификации на готовый продукт, технологические инструкции, бланки для выпуска серий и т.д.) и многократно проводить все необходимые мероприятия по их вводу и последующему аннулированию.
Вопрос 2:
Возможно ли при производстве лекарственного препарата использовать часть ранее утвержденных документов (например, нормативный документ по качеству) и часть новых документов (например, макеты упаковки) при наличии переходного периода?
Ответ: Нет. Такой вариант развития событий противоречит законодательству вне зависимости от наличия или отсутствия переходного периода. «Кусочничать» при производстве лекарственных препаратов недопустимо.
Данная статья является частью проекта «Регуляторная осознанность». Другие материалы проекта доступны на сайте.





