Актор: ИРИНА КРАСНОВА, заместитель директора департамента развития производства и регистрации OOO «НПФ «Материа Медика Холдинг»
Данная статья посвящена стратегии контроля вспомогательных веществ, а именно ее отражению в регистрационном досье и документах фармацевтической системы качества. Информация будет представлена в контексте следующих аспектов:
1. приемлемое качество вспомогательных веществ, используемых при производстве лекарственных препаратов;
2. подготовка раздела по контролю качества вспомогательных веществ в составе регистрационного досье, в том числе подготовка обоснований спецификаций.
Чаще всего вопрос: «Какое качество вспомогательных веществ считается приемлемым при производстве лекарственных препаратов?» встает при выборе нового поставщика вспомогательного вещества для выпускаемого или нового лекарственного препарата.
Для ответа обратимся к определению вспомогательных веществ (таблица 1).

Представленная выше информация позволяет сделать вывод, что в рассматриваемом контексте «надлежащее качество» не является синонимом «фармакопейное качество». Другими словами, если некоторое вспомогательное вещество А имеет сертификат производителя, подтверждающий его соответствие требованиям монографии соответствующей фармакопеи, то это подтверждает только факт того, что данное вспомогательное вещество А является веществом А (а не В, С или D) и характеризуется количественным содержанием и содержанием примесей в установленном монографией диапазоне. При этом соответствие фармакопейным требованиям (так называемое фармакопейное качество) не гарантирует, что данное вспомогательное вещество А позволит получить лекарственный препарат X надлежащего качества.
Причина очевидна и заключается в том, что возможность получить лекарственный препарат надлежащего качества обусловлена преимущественно функциональными характеристиками вспомогательных веществ, то есть физическими или химическими параметрами вспомогательных веществ, обуславливающими их пригодность к функциональному назначению.
В большинстве своем монографии фармакопей на вспомогательные вещества регламентируют такие показатели как «подлинность», «количественное содержание» и содержание примесей. То есть показатели, значение которых в установленных пределах прежде всего позволяет гарантировать безопасность лекарственного препарата. Как правило, фармакопейные требования – это некий базовый уровень с точки зрения контроля качества вспомогательных веществ. Понимание того, какие характеристики сырья влияют на критические показатели качества лекарственного препарата, являясь критическими показателями качества вспомогательных веществ1, и обеспечивают получение лекарственного препарата надлежащего качества, эффективности и безопасности, дает целевой профиль качества лекарственного препарата2. Очевидно, что перечень таких показателей и критериев приемлемости могут существенно варьировать в зависимости от лекарственного препарата, в состав которого они входят. И то, что приемлемо или вовсе не имеет значения при производстве одного лекарственного препарата, будет играть критическую роль при производстве другого.
Данный тезис наглядно демонстрирует лактоза, которая широко используется при производстве большого количества лекарственных препаратов. На рынке представлено большое количество марок данного вспомогательного вещества. Все они могут соответствовать фармакопейным требованиям (LACTOSE MONOHYDRATE 04/2023:0187, ФС.2.1.0119 ЛАКТОЗА МОНОГИДРАТ (ЛАКТОЗА)), но существенно отличаться распределением частиц по размерам и, как следствие, иметь значимые отличия в таких технологических характеристиках, как насыпная плотность, индекс Хауснера, связывающая способность, прессуемость, сыпучесть и т.д. В зависимости от совокупности вышеуказанных свойств, разные марки лактозы приемлемы для разных лекарственных форм.
Целесообразно на этапе фармацевтической разработки проводить определение критических показателей качества вспомогательных веществ с использованием принципов управления рисками для качества и включать их в спецификации. Последние, в свою очередь, являются элементами так называемой стратегии контроля3, которая предназначена для обеспечения постоянного производства продукции необходимого качества.
Такой подход, безусловно, является проактивным и требует разносторонних глубоких знаний и соответствующей доказательной базы, основанной на многочисленных многофакторных экспериментах. Однако затраченные усилия с лихвой «окупаются» в будущем за счет минимизации трудовременных затрат, риска регуляторного несоответствия и риска доступности лекарственных препаратов при сохранении их высокого качества.
Таким образом, чтобы гарантировать надлежащее качество лекарственного препарата, недостаточно соответствия вспомогательного вещества фармакопейным требованиям. При этом отсутствие сертификата качества, подтверждающего соответствие вспомогательного вещества требованиям монографии фармакопеи, не стоит рассматривать как априори безапелляционный аргумент для отказа от использования вспомогательного вещества при производстве лекарственных препаратов. Вышесказанное подтверждают требования Европейской фармакопеи (EP 11.0)4, согласно которой регулятор может расценить спецификацию, описанную в монографии фармакопеи, недостаточной для обеспечения качества соответствующего лекарственного препарата и запросить у производителя/заявителя более подходящие спецификации.
В зависимости от степени соответствия монографии фармакопеи – следующие варианты спецификаций для вспомогательных веществ5 (таблица 2).
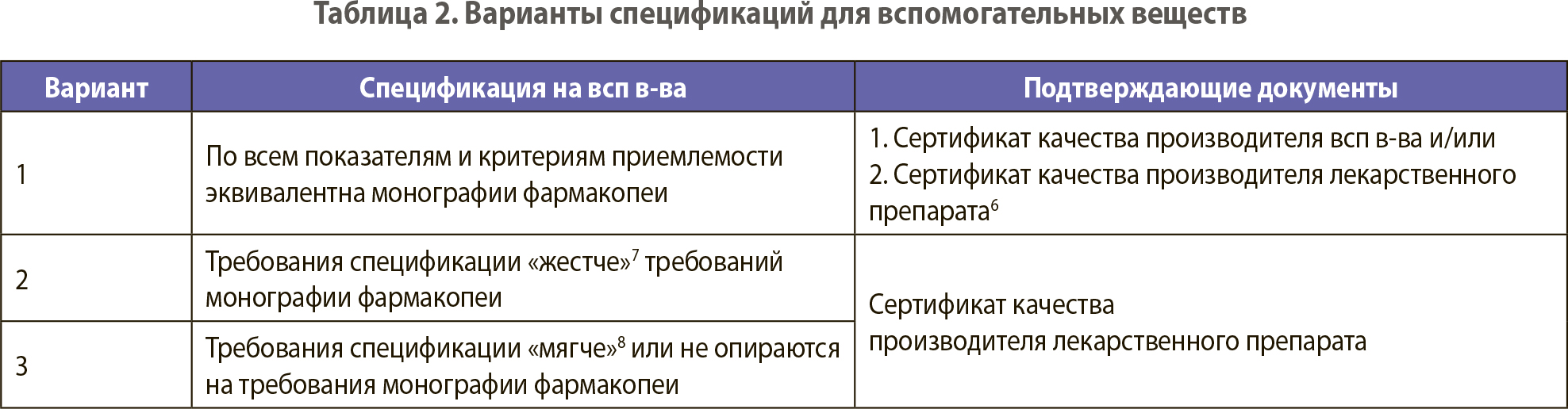
Информация по контролю качества вспомогательных веществ отражается в следующих разделах регистрационного досье:
3.2.Р.4.1 Спецификации на вспомогательные вещества;
3.2.Р.4.2 Аналитические методики;
3.2.Р.4.3 Валидация аналитических методик;
3.2.Р.4.4 Обоснование спецификаций;
3.2.Р.4.5 Вспомогательные вещества человеческого и животного происхождения;
3.2.Р.4.6 Новые вспомогательные вещества.
В зависимости от степени соответствия требований к контролю качества вспомогательных веществ, установленных производителем лекарственного препарата, фармакопейным требованиям, возможны 2 варианта наполнения раздела 3.2.Р.4 регистрационного досье (таблица 3).

Резюме
1. Вспомогательные вещества могут быть использованы для производства лекарственных препаратов в случае, если они позволяют обеспечить надлежащее качество последних. Поэтому при выборе вспомогательных веществ первостепенным является ответ на вопрос: «Какие их характеристики критически важны для качества лекарственного препарата?».
2. При регламентировании качества вспомогательных веществ следует учитывать разные показатели, позволяющие всесторонне оценивать их качество. Целесообразно проводить определение критических показателей качества вспомогательных веществ на этапе фармацевтической разработки и включать их в спецификации. Такой подход в долгосрочной перспективе позволяет минимизировать трудовременные затраты, а также риск регуляторного несоответствия и риск доступности лекарственных препаратов при сохранении их высокого качества.
3. Использование вспомогательных веществ фармакопейного качества и подготовка на них спецификаций на основе соответствующих монографий упрощает подготовку раздела 3.2.Р.4 регистрационного досье и, как правило, вызывает меньше вопросов при его экспертизе.
Оба подхода характеризуются преимуществами и недостатками при их рассмотрении в краткосрочной и долгосрочной перспективе и имеют место.
Приемлемый вариант не может быть выбран без учета контекста и всесторонней оценки ситуации.
Как известно, правда – это только грань истины.
Данная статья является частью проекта «Регуляторная осознанность». Другие материалы проекта доступны на сайте.





