Автор: Белинский Александр, ведущий специалист по квалификации PQE ЕАЭС
Предваряя статью, в которой емко охарактеризован принятый FDA стандарт ASTM E2500, часто называемый lean validation, следует заметить, что в ЕС и ЕАЭС нужно не упускать из фокуса своего внимания действующее приложение 15, где сформулированы требования к квалификации и валидации. Конечно, рациональное зерно стоит взять из стандарта ASTM E2500, тем более, что его логика в ряде случаев созвучна приложению 15
Приведу примеры. В приложении 15 есть п. 3.6 (п. 27 в редакции ЕАЭС), который говорит о том, что не следует дублировать испытания на стадиях IQ/OQ, выполненные в рамках FAT и на других стадиях, если показано, что это не повлияет на функциональность оборудования после транспортировки и установки. Также рациональным можно назвать п. 3.10 (п. 31 в редакции ЕАЭС), где допускается объединение стадий IQ и OQ в одну стадию – IOQ. И действительно, часто гадают, к какой стадии отнести то или иное испытание, в ситуациях, не требующих этого и не формирующих добавочную цен-ность. Скажем, проверка версии установленного программного обеспечения – это IQ? Вроде бы да – ведь это документированное подтверждение корректности установки. Но для того, чтобы это сверить, нужно включить оборудование, а это уже элемент функционирования, т. е. OQ. Решить вопрос какая же это стадия – I Q или OQ – можно созданием совмещенной стадии IOQ. Во всяком случае, такую возможность предоставляет приложение 15 GMP EU (и ЕАЭС).
Вместе с тем, ASTM E2500 является значительно более гибким стандартом в противовес «жестко закрепленной последовательности» в приложении 15. И тут мы пока вынуждены действовать с оглядкой на букву закона.
Однако, я надеюсь, что со временем подходы будут выравниваться. Собственно, ради этого работают ICH, рассинхронизация в подходах США (FDA) и ЕС (ЕМА) всегда присутствует в фокусе руководств ISPE, PDA и т. п. Поэтому хотелось бы, чтобы в обозримом будущем рациональные подходы смогли быть адаптированы более легко и оперативно. Ведь не стоит забывать, что основная ценность валидации – это уверенность в воспроизводимом процессе, продукте, функционировании системы, а вовсе не доказательство деньгами. Соответственно, в этом направлении почти всегда есть потенциал к совершенствованию. Обзор стандарта ASTM E2500 раскрывает этот потенциал. Ведь заметьте, обсуждаемый ныне в ЕС проект приложения 1 GMP EU тоже заимствует некоторые рациональные элементы из руководства FDA. Так что есть надежда на конвергенцию подходов в будущем.
СТАНДАРТ ASTM E2500: НОВЫЙ ПОДХОД К ВАЛИДАЦИИ
ASTM E2500 – это стандарт, относящийся к спецификации, проектированию и верификации систем и оборудования фармацевтического и биотехнологического производства. Он применим к оборудованию, системам/процессам, системам обеспечения производства, лабораторным системам, IT системам и системам автоматизации, которые могут влиять на качество продукции и безопасность пациентов.
Стандарт ASTM E2500 был впервые опубликован в июне 2007 года и повторно утвержден в 2012 году. Он соответствует международным нормативным требованиям, таким как ICH Q8, ICH Q9, ICH Q10 (фармацевтическая разработка/»качество через дизайн», управление рисками для качества, фармацевтическая система качества). Этот подход, широко используемый в США и поддерживаемый FDA, также внедряется в Европе, в особенности производителями для рационализации этапов тестирования систем с целью сокращения времени выхода на рынок.
ASTM E2500 имеет ряд сходств с традиционным процессом V-модели, однако проводимые испытания больше не следуют жесткой последовательности FAT/SAT/IQ/OQ/PQ, как описано в Приложении 15 EU GMP. Теперь они объединены под общим термином «верификация» и могут быть более рационально организованы и более эффективно адаптированы к каждому контексту.
МОДЕЛЬ ASTM E2500: 4 ШАГА
ASTM E2500: МОДЕЛЬ ASTM E2500 ПОСТРОЕНА НА 4 ШАГАХ, 4 МЕЖФУНКЦИОНАЛЬНЫХ ПРОЦЕССАХ, А ТАКЖЕ НА 3 ОСНОВНЫХ УЧАСТНИКАХ.
4 ШАГА:
Требования. Они являются документальной основой верификации. Важно, чтобы потребности пользователя и критические аспекты были четко определены экспертом предметной области и включали в себя знание продукта, производственного процесса, нормативных требований, а также внутренних требований компании.
Спецификации и проект. Этот этап направлен на проверку того, что поставщик и различные участники процесса приняли во внимание решения, предложенные поставщиками, и они предельно понятны.
Верификация. Она основана на двух основных принципах: «правильный тест», проведенный в «правильное время» = «правильный с первого раза» тест. Если его провести слишком рано, то достоверность результатов может быть искажена изменениями, а проведение тестирования слишком поздно подрывает график проекта.
Тестирование повторяется только при необходимости или в случае изменений, поэтому некоторые тесты могут проводиться на площадке поставщика полностью или частично, а некоторые тесты могут быть делегированы поставщикам, поскольку они являются экспертами в своих собственных системах.
Приемка и выпуск. Это подготовка системы к вводу в эксплуатацию. На этом этапе составляется сводный документ, в котором перечисляются все проведенные тесты, даты их проведения и их статус. После этого конкретная система может быть переведена на следующий этап.
Если на этапе перехода остаются замечания, они должны касаться только некритичных аспектов, и должны быть определены сроки их устранения.
МОДЕЛЬ ASTM E2500: 4 МЕЖФУНКЦИОНАЛЬНЫХ ПРОЦЕССА
4 МЕЖФУНКЦИОНАЛЬНЫХ ПРОЦЕССА:
Надлежащая инженерная практика: четко определенная и распространенная (среди участников – прим. перев.) организационная структура с начала проекта облегчает его реализацию, так же как и неопределенные организационные действия в начале про-екта неизбежно приведут к техническим проблемам.
Управление рисками для качества. Ориентированный на продукт анализ рисков проводится для определения на самой ранней стадии всех критических параметров с точки зрения качества продукта/ безопасности пациента (CQA, CPP), что позволяет заблаговременно проверить критические аспекты системы/установки с точки зрения GMP.
Обзор проекта – пошаговая фаза, основанная на проектной документации поставщика, для обеспечения соответствия проекта системы требованиям. Он направлен на снижение необходимости внесения изменений после передачи системы конечному пользователю, а также на избежание повторных тестирований после внесения изменений. Этот процесс следует повторять при каждом изменении системы.
Управление изменениями. При подходе ASTM E2500 процесс управления изменениями начинается раньше проведения тестирования на площадке поставщика, что позволяет избежать повторных тестирований при условии эффективного управления.
МОДЕЛЬ ASTM E2500: КЛЮЧЕВЫЕ УЧАСТНИКИ
3 ОСНОВНЫХ УЧАСТНИКА:
Эксперты предметной области. Они играют решающую роль в подходе ASTM E2500. Они необходимы с самого начала проекта и вносят свой вклад в определение потребностей, выявление критических аспектов, обзора проекта системы, разработку стратегии верификации и выбор критериев приемлемости. Эксперты предметной области также играют ведущую роль в подходе анализа рисков для качества.
Поставщики. Основные эксперты по системам могут быть приглашены для проведения определенных ве-рификационных тестов, направленных на более лег-кое достижение цели «правильного тестирования», выполненного «в правильное время» («правильно с первого раза»). В рамках ASTM E2500 поставщики играют важную роль. Они должны быть знакомы с принципами ASTM E2500 и обучены нормативным требованиям, особенно в отношении надлежащей документальной практики.
Отдел обеспечения качества, который контролирует и обращает внимание на критические аспекты процессов и систем, в частности, проверяет все критерии приемки при верификации.
ASTM E2500: ВЫВОДЫ И ОСНОВНОЙ ГЛОССАРИЙ
В заключение: ASTM E2500 – это подход, который охватывает весь процесс проекта с участием многих сторон, начиная с этапа определения потребностей, что позволяет проводить более раннюю верификацию и выполнять необходимые тестирования в нужное время.
Валидация выполняет роль связующего звена между инженерными службами и отделом обеспечения качества и становится более важной при применении подхода, основанного на оценке рисков, поскольку они лучше понимают предполагаемое использование системы и ее риски, поэтому они могут легко установить и обосновать, почему опре-деленные тестирования проводятся, а другие функции не тестируются, основываясь на оценке рисков.
Если ASTM E2500 – это тело стратегии валидации компании, то отдел валидации становится сердцем этого тела.
Белинский Александр, ведущий специалист по квалификации PQE ЕАЭС. Чтобы получить консультацию, обратитесь в Компанию PQE ЕАЭС.

ОСНОВНОЙ ГЛОССАРИЙ
ASTM: Американское общество по испытанию материалов
C&Q: Ввод в эксплуатацию и квалификация
CPP: Критический параметр процесса
CQA: Критический параметр качества
CQV: Ввод в эксплуатацию, квалификация и валидация
FAT: Приемо-сдаточные испытания на заводеизготовителе
GEP: Надлежащая инженерная практика
GMP: Надлежащая производственная практика
IQ: Квалификация монтажа
OQ: Квалификация функционирования
PQ: Квалификация эксплуатации
QA: Обеспечение качества
SAT: Приемочные испытания у заказчика
SME: Эксперт предметной области
Контакты:
Адрес: 127015, Москва, ул. Новодмитровская 2к2 БЦ Савёловский Сити, башня Davis
Телефон: +7 (495) 133 98 36
E-mail: ru.info@pqegroup.ru
Web: www.pqegroup.ru






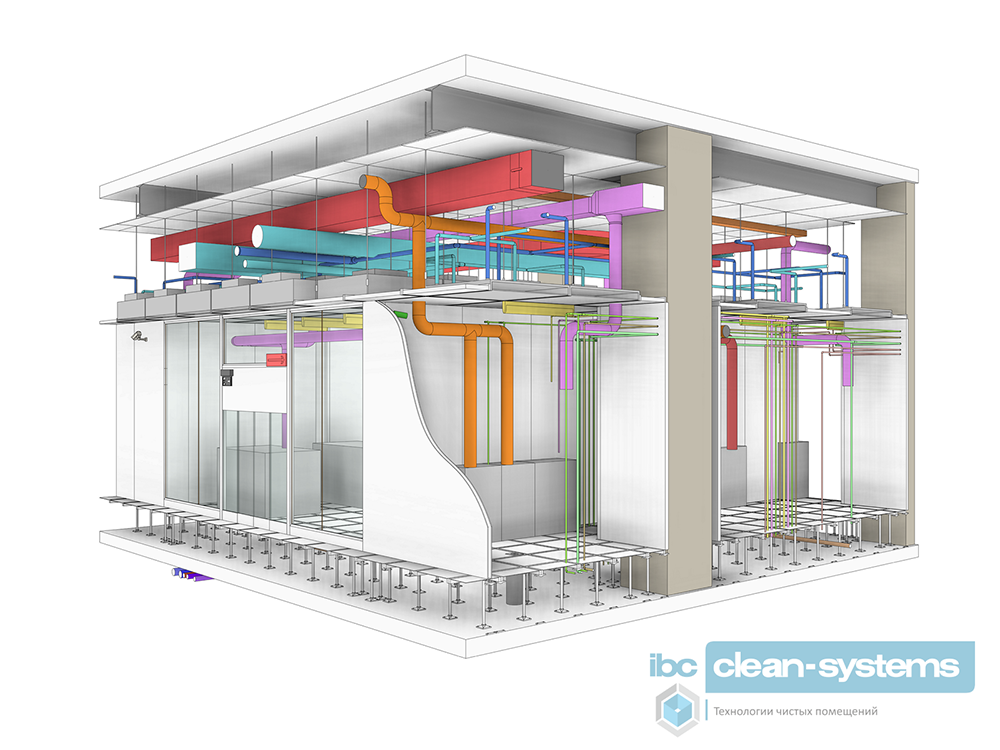
 Сфера деятельности IBC Clean-systems:
Сфера деятельности IBC Clean-systems: Все компоненты, применяемые в панели PSW делают ее полностью герметичной, исключающей возможность контаминации и применимой в чистых помещениях.
Все компоненты, применяемые в панели PSW делают ее полностью герметичной, исключающей возможность контаминации и применимой в чистых помещениях.







 6 ОСНОВНЫХ ПРИЧИН ВЫБРАТь КОМПАНИЮ «ФАРМИНЖИНИРИНГ» В КАЧЕСТВЕ ПАРТНЕРА:
6 ОСНОВНЫХ ПРИЧИН ВЫБРАТь КОМПАНИЮ «ФАРМИНЖИНИРИНГ» В КАЧЕСТВЕ ПАРТНЕРА: «КОНТУР» собирается аналогично конструктору «Lego» благодаря тому, что все составные элементы изготавливаются сразу в размер, согласно индивидуально разработанному монтажному проекту. Быстрый монтаж и демонтаж стеновых элементов обеспечивают удобный и оперативный доступ к скрытым инженерным коммуникациям при необходимости их ревизии или срочной замене поврежденных деталей самой конструкции. Также возможно произвести полноценный перенос всей конструкции без замены элементов, либо интегрировать в другие конструкции чистых помещений. Кроме того, специалистами компании регулярно разрабатываются и выводятся на рынок новые усовершенствованные ограждающие конструкций для чистых помещений.
«КОНТУР» собирается аналогично конструктору «Lego» благодаря тому, что все составные элементы изготавливаются сразу в размер, согласно индивидуально разработанному монтажному проекту. Быстрый монтаж и демонтаж стеновых элементов обеспечивают удобный и оперативный доступ к скрытым инженерным коммуникациям при необходимости их ревизии или срочной замене поврежденных деталей самой конструкции. Также возможно произвести полноценный перенос всей конструкции без замены элементов, либо интегрировать в другие конструкции чистых помещений. Кроме того, специалистами компании регулярно разрабатываются и выводятся на рынок новые усовершенствованные ограждающие конструкций для чистых помещений. и бригады монтажников позволяют оперативно доставить и качественно смонтировать конструкции на объекте.
и бригады монтажников позволяют оперативно доставить и качественно смонтировать конструкции на объекте.

 Основными преимуществами компании «ФармИнжиниринг» являются:
Основными преимуществами компании «ФармИнжиниринг» являются:
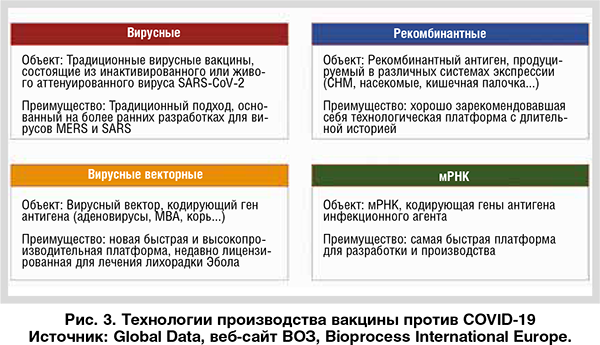
 Мировой рынок вакцин значительно вырос из-за роста населения планеты, распространения иммунизации и выхода на рынок новых вакцин. В условиях пандемии COVID-19 вполне ожидаемо, что этот тренд будет и далее набирать обороты. Потребность в производстве миллиардов доз вакцины против COVID-19 сверх существующего спроса. Для решения поставленной задачи фармацевтические компании непрерывно оценивают варианты использования имеющихся мощностей путем их расширения. В краткосрочной перспективе они могут увеличить объем работ, передаваемых на аутсорсинг контрактным производителям (СМО), или перепрофилировать существующие производственные мощности. В долгосрочной перспективе, в качестве альтернативы, компан
Мировой рынок вакцин значительно вырос из-за роста населения планеты, распространения иммунизации и выхода на рынок новых вакцин. В условиях пандемии COVID-19 вполне ожидаемо, что этот тренд будет и далее набирать обороты. Потребность в производстве миллиардов доз вакцины против COVID-19 сверх существующего спроса. Для решения поставленной задачи фармацевтические компании непрерывно оценивают варианты использования имеющихся мощностей путем их расширения. В краткосрочной перспективе они могут увеличить объем работ, передаваемых на аутсорсинг контрактным производителям (СМО), или перепрофилировать существующие производственные мощности. В долгосрочной перспективе, в качестве альтернативы, компан
 ПРОИЗВОДСТВА НОВОГО ПОКОЛЕНИЯ
ПРОИЗВОДСТВА НОВОГО ПОКОЛЕНИЯ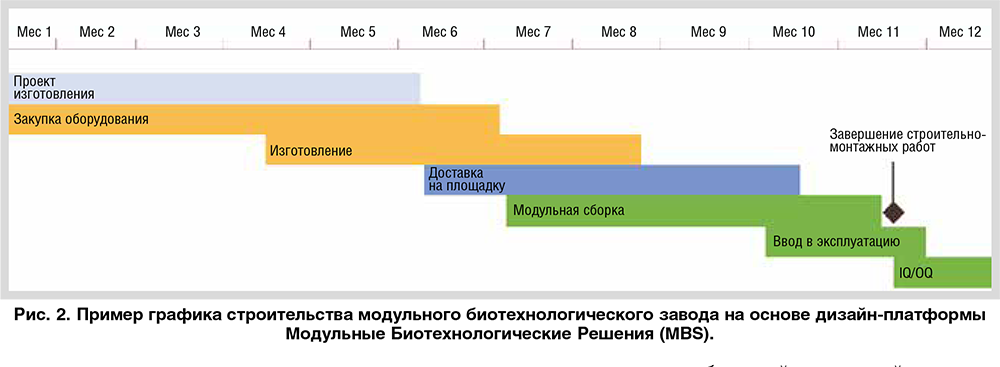
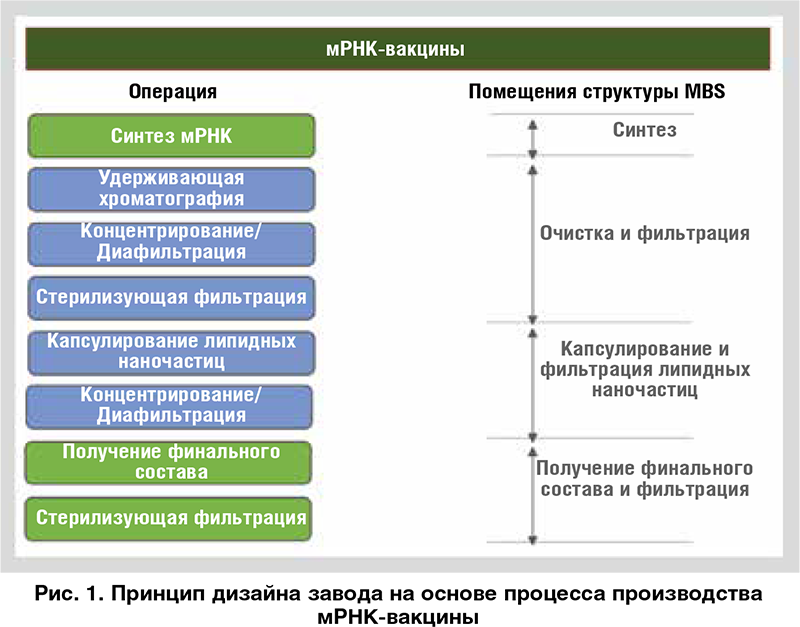
 Ключевым принципом при проектировании завода является разработка планировки на основе технологического процесса. Когда этапы процесса установлены, переходят к определению необходимых производственных помещений. В качестве примера на Рисунке 1 показан принцип дизайна завода на основе процесса производства мРНК-вакцины с указанием категории помещений, которой соответствует каждый этап процесса. После определения функциональности производственных помещений обычно выполняется анализ смежности для оптимизации планировки, и далее переходят к детализации всего завода.
Ключевым принципом при проектировании завода является разработка планировки на основе технологического процесса. Когда этапы процесса установлены, переходят к определению необходимых производственных помещений. В качестве примера на Рисунке 1 показан принцип дизайна завода на основе процесса производства мРНК-вакцины с указанием категории помещений, которой соответствует каждый этап процесса. После определения функциональности производственных помещений обычно выполняется анализ смежности для оптимизации планировки, и далее переходят к детализации всего завода. ВЗГЛЯД В БУДУЩЕЕ
ВЗГЛЯД В БУДУЩЕЕ



 KeyPlants
KeyPlants