Авторы: МЭТТ РИЧАРДСОН, доктор наук, менеджер по развитию коммерческой деятельности в области фармацевтической продукции – капсул и ингредиентов для здоровья (LONZA). ВИНСЕН ЖАННИН, доктор наук, руководитель лаборатории по применению капсул и ингредиентов для здоровья (LONZA)
По мере того, как фармацевтическая разработка все больше движется в сторону препаратов, ориентированных на нишу, или лекарственных препаратов, «занимающих нишу», разработчики рецептур часто сталкиваются с проблемой, связанной с плохо всасываемыми активными фармацевтическими ингредиентами (АФИ). В результате был разработан ряд пероральных лекарственных форм для преодоления проблем с биодоступностью и всасыванием сложных рецептур лекарственных препаратов. В этой статье обсуждается вопрос о том, как рецептура на основе липидов (LBF) может помочь улучшить биодоступность, исследуется использование аморфных твердых дисперсий (ASD) для увеличения всасывания и предлагаются некоторые рекомендации по выбору капсулы, которая будет соответствовать требованиям разработки.
ТЕКУЩИЙ КОНТЕКСТ
Информация из базы данных PharmaCircle™ [1], собранная в апреле 2021 года, указывает на то, что из 4523 новых молекулярных единиц в процессе разработки пероральных лекарственных препаратов только 30% соответствовали критериям, которые должны определять эти препараты как растворимые или имеющие низкую растворимость; остальные не указаны. По мере того, как лекарственные препараты проходят этапы разработки от доклинических исследований до регистрации, количество лекарственных препаратов с неопределенной растворимостью уменьшается, как и следовало ожидать, но при этом низкая растворимость преобладает, составляя 93–97% всех разрабатываемых лекарственных средств.
Лекарственные препараты с низкой растворимостью делятся на две категории в зависимости от их физикохимических свойств: типа кирпичной пыли, обычно имеющие высокую температуру плавления с пороговым уровнем около 200 °C; и жирные шарики – соединения, которые демонстрируют растворимость, ограниченную сольватацией, и обычно связаны с высоким коэффициентом распределения (logP), который указывает на липофильность с пороговым уровнем от 2,0 до 3,6. Надлежащее определение критических свойств материала (CMA) лекарственных препаратов является ключом к выбору правильной технологии, позволяющей устранить причину низкой растворимости.
ВАРИАНТЫ РЕЦЕПТУР
В настоящее время существует множество вариантов активации рецептур. Общие стратегии рассмотрены в справочном документе 2, а в справочных документах 3 и 4 представлены современные обзоры различных технологий вместе с текущими проблемами и перспективами их использования при разработке лекарственных средств (2–4).
К наиболее распространенным относятся:
- Уменьшение размера частиц для улучшения растворения в требуемой среде;
- Системы на основе липидов, растворяющие лекарственные препараты, растворимость которых ограничена сольватацией, и которые также могут оказывать действие, внося изменения в локальную среду солюбилизации желудочнокишечного тракта (ЖКТ);
- Аморфные твердые дисперсии (ASD), в которых барьер для растворимости устраняется путем преобразования кристаллического лекарственного средства в аморфное состояние.
Как LBF, так и ASD широко применяются для повышения общей жизнеспособности соединений с ограниченной растворимостью. По данным PharmaCircle™, полученным в апреле 2021 года, в настоящее время в разработке находится примерно такое же количество проектов, в которых используются эти методы (1). LBF и ASD не только способны увеличивать растворимость, но также могут способствовать всасыванию лекарственных средств, ингибируя некоторые функции экспорта клеток, таких как P-гликопротеин, и обеспечивая возможность проталкивания лекарственного средства через эпителий за счет перенасыщения лекарственного средства в просвете кишечника. На Рисунке 1 показано количество статей, перечисленных в PubMed по методикам LBF и ASD с 1987 по 2021 год, и показано их резкое увеличение за последнее десятилетие, что отражает текущие исследования этих методов по мере того, как ученые стремятся расширить их применение.
ИЗУЧЕНИЕ РЕЦЕПТУР НА ОСНОВЕ ЛИПИДОВ
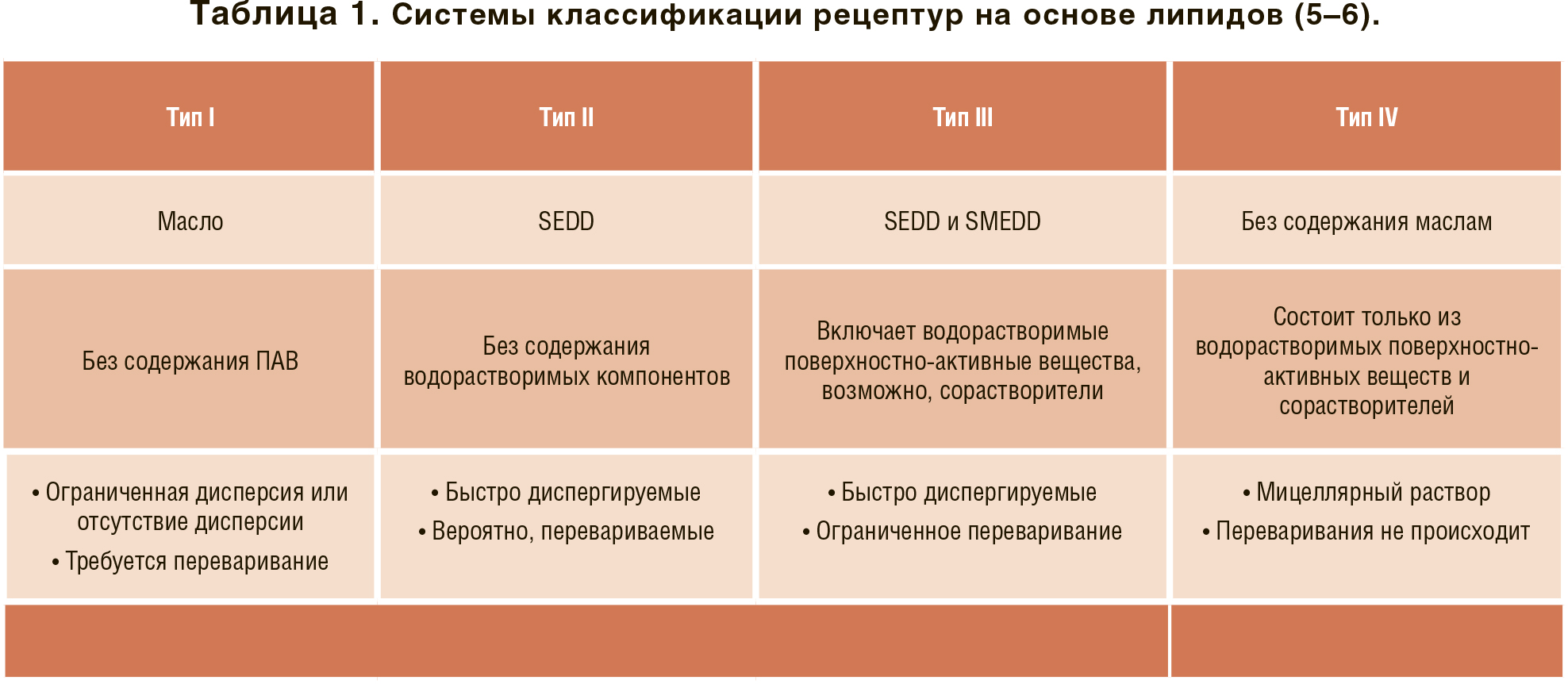
LBF в основном представляют собой изотропные растворы лекарственного препарата в смеси жидких или полутвердых вспомогательных веществ. Большинство из них фасуют и запечатывают в твердые капсулы, что для полутвердых препаратов влечет за собой плавление и поддержание их в жидкой форме в течение всего процесса инкапсуляции. Лекарства кандидаты в LBF обычно представляют собой жирные шарики с ограниченной растворимостью. Обычно лекарственный препарат растворяет ся в LBF перед инкапсуляцией, но есть исключения, когда лекарственный препарат находится в суспензии в самом липиде, который затем растворяется в ЖКТ за счет выгодной модификации кишечных коллоидов липидом или липидным метаболитом рецептуры. Рецептуры LBF можно классифицировать, как показано в Таблице 1, в зависимости от их состава и поведения при контакте с водными жидкостями.
Рецептуры типа I состоят только из масел, в основном смесей моно-, ди- и триглицеридов растительного происхождения, без поверхностно-активного вещества. Эти рецептуры подходят для высоколипофильных соединений жирных шариков с высоким logP. Рецептуры типа II, также известные как самоэмульгирующиеся системы лекарственной доставки (SEDD), содержат масло, воду и растворимые поверхностно-активные вещества, они способны образовывать грубые эмульсии в водной среде. Рецептуры типа III являются более гидрофильными версиями SEDD, которые могут образовывать микро- или даже наноэмульсии при контакте с водной средой. Рецептуры ти па III представляют собой более гидрофильные версии SEDD, которые могут образовывать микро- или наноэмульсии при контакте с водной средой. Они быстро образуют мицеллярные растворы при контакте с водной средой и наиболее подходят для менее липофильных соединений.
Основные характеристики LBF и степень их влияния на процесс всасывания:
- Поддержание солюбилизации на этапе диспергирования/переваривания в просвете желудочнокишечного тракта;
- Способствует эффективной диффузии через слой слизи для достижения кишечного эпителия;
- Может открывать плотные сое динения и способствовать па рацеллюлярному захвату;
- Может подавлять пресистемный метаболизм;
- Может стимулировать секрецию хиломикронов и способствовать лимфатическому захвату.
Это делает LBF мощными инструментами для решения некоторых из наиболее сложных проблем АФИ.
ПРАКТИЧЕСКИЕ АСПЕКТЫ РАБОТЫ С LBF
Одним из наиболее заметных аспектов применения LBF является повышение биодоступности плохо растворимых в воде АФИ – категории, которая продолжает доминировать в спектре сложных фармацевтических субстанций. Самоэмульгирующиеся рецептуры и рецептуры с самопроизвольным формированием микроэмульсии использовались для решения проблем водорастворимости в ряде продаваемых на рынке лекарственных препаратов. Солюбилизация соединения в липидной матрице также предлагает эффективную стратегию для смягчения таких проблем, как достижение однородности дозы в составах с низкой дозировкой и преодоление проблем, связанных с мелкими частицами и пылью при работе с АФИ с высокой эффективностью, что снижает риски, связанные с обращением с рецептурой.
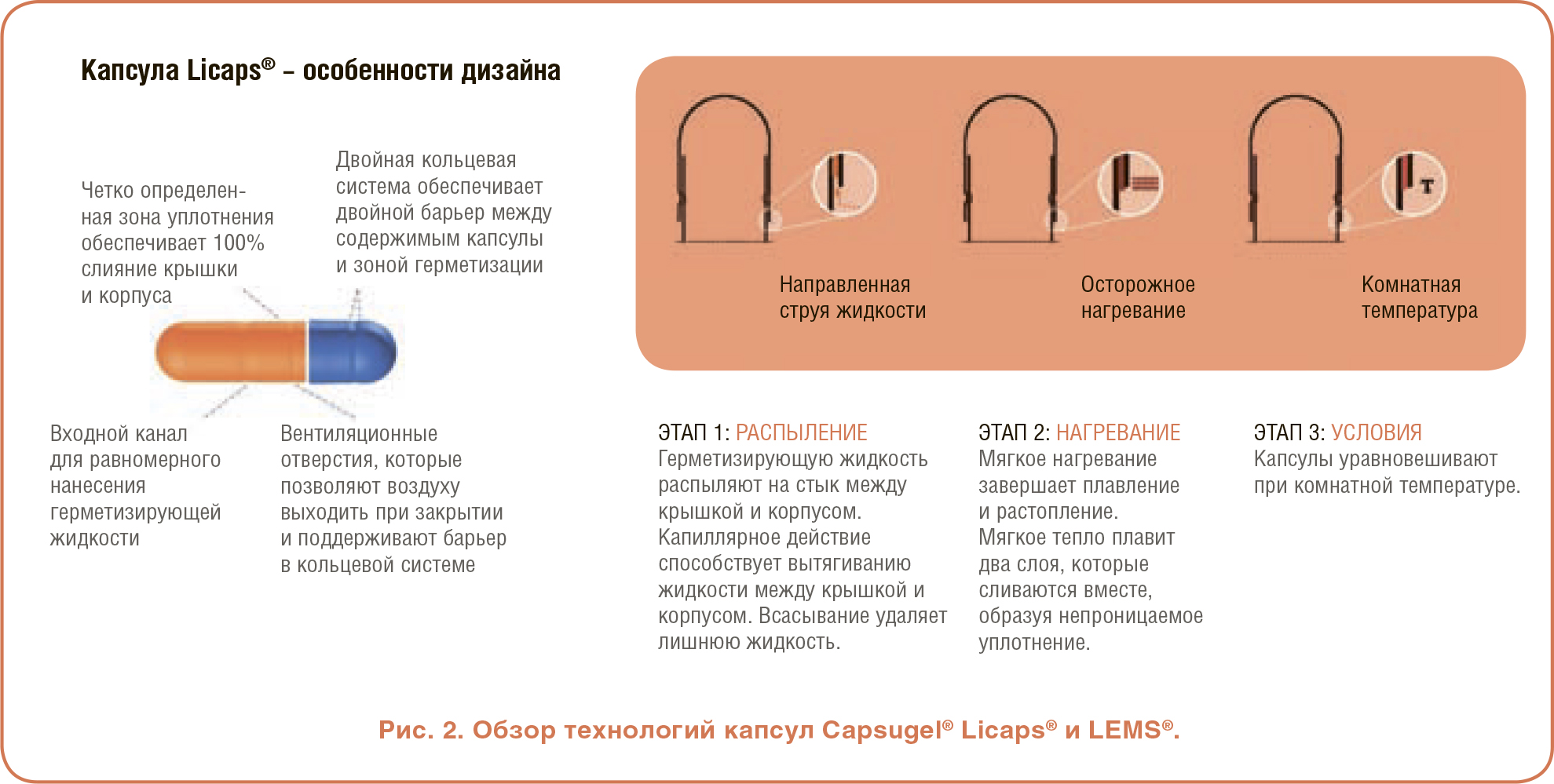
Все эти жидкие рецептуры затем требуют подходящей фасовки, которая для пероральной доставки включает технологию мягких гелевых или твердых капсул. Однако не все твердые капсулы подходят для фасовки, и для этих уникальных рецептур требуются капсулы, специально разработанные и оптимизированные для работы со средами на основе липидов. Достижения в области технологий и дизайна теперь обеспечивают решения, которые более эффективно отвечают строгим требованиям, связанным с сегодняшними LBF, и примером этого являются твердые капсулы Capsugel® Licaps® (см. Рисунок 2). Эта герметичная капсула, состоящая из двух частей, снижает вероятность утечки и вскрытия, а выбор полимеров помогает справиться с дополнительными проблемами, такими как чувствительность к влаге, кислороду или свету. Критически важна система двойных колец, которая удерживает рецептуру вдали от зоны уплотнения и поддерживает целостность. Капсулы укупоривают с использованием процесса герметизации методом жидкого капсулирования с помощью микроопрыскивания (LEMS), а фасовка и герметизация могут выполняться в различных масштабах – от лабораторного опытного изготовления с масштабированием до небольшого коммерческого производства и полного промышленного производства.
 РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ
РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ
Ключевой характеристикой аморфных лекарственных препаратов является то, что они более растворимы, чем их кристаллические аналоги, что приводит к общей более высокой биодоступности. Однако главный недостаток состоит в том, что вещества в аморфном состоянии менее стабильны и имеют тенденцию возвращаться к более упорядоченной кристаллической форме. Чтобы поддерживать лекарственный препарат в аморфной форме и продлевать его стабильность с течением времени, требуется добавление полимеров, таких как гипромеллоза (гидроксипропилметилцеллюлоза или ГПМЦ) или гипромеллозы ацетата сукцинат (ГПМЦАС), оба из которых являются аморфными вспомогательными веществами. Затем смесь лекарственного средства и полимера обрабатывают распылительной сушкой, экструзией из горячего расплава или измельчением для преобразования кристаллического материала в аморфное состояние. Это превращение отслеживают с помощью дифференциальной сканирующей калориметрии (DSC) для проверки отсутствия пиков плавления и наличия менее интенсивного стеклования. Рентгеноструктурный анализ (XRD) подтверждает исчезновение пиковых характеристик кристаллической фазы и появление аморфного гало. На конец, форму аморфной частицы можно исследовать с помощью сканирующей электронной микроскопии (SEM).
Основные характеристики ASD суммированы на Рисунке 3, где график показывает концентрацию лекарственного препарата в растворе как функцию зависимости от времени. Кривая 1 представляет собой кристаллическую форму, которая является медленной и ограниченной и, на конец, достигает равновесной растворимости лекарственного средства. Кривая 2 представляет собой ASD того же лекарственного препарата, где наблюдается быстрое и обширное растворение – эффект пружины – но также и неспособность поддерживать перенасыщение (концентрацию выше равновесной растворимости) с течением времени. Кривая 3 показывает ASD с добавлением ГПМЦ. Этот полимер представляет собой парашют, который помогает избежать кристаллизации лекарственного средства и поддерживать более длительное перенасыщение in vivo, чтобы ускорить и дать больше времени для всасывания лекарственного средства. Таким образом, кривая 3 показывает эффект пружины с быстрым и обширным растворением лекарственного средства, но, в отличие от кривой 2, также присутствует парашютный эффект. Эффекты пружины и парашюта описаны во многих публикациях, одним из примеров которых является справочный документ 10, и хорошо объяснены в недавнем видео на YouTube (11).
Еще одной важной характеристикой ASD является их при годность для производства с помощью распылительной сушки, которая имеет широкое применение для различных соединений, просто регулируя полимер, растворитель или условия обработки. Наконец, одним из основных преимуществ ASD является возможность использовать этот метод с высокими дозами соединений.
 УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
Некоторые соединения, в основном слабоосновные молекулы, обладают высокой растворимостью при низком pH в желудочной среде, но быстро кристаллизуются при более высоком pH в кишечнике. Известно, что ГПМЦ ингибирует эти взаимодействия. Растворяясь с активной рецептурой, она способствует перенасыщению и снижает количество действующего вещества, которое кристаллизуется при более высоком pH. ГПМЦ использовалась в качестве добавки в составе ASD для решения аналогичных проблем, и было предложено, что включение этого полимера в саму оболочку капсулы может улучшить характеристики солюбилизации таким образом, чтобы оставить больше места в капсуле для улучшения за грузки лекарственного средства.
Экспериментальная работа с использованием эрлотиниба, слабоосновной молекулы, которая примерно вдвое меньше растворима в моделированной кишечной жидкости, чем в моделированной желудочной жидкости, демонстрирует концепцию поддержания растворимости в кишечном pH.Высушенные распылением рецептуры препаратов Эрлотиниб и Eudragit® L100 SDD (функциональный полимер с замедленным высвобождением) загружали как в твердые желатиновые, так и в капсулы из ГПМЦ без гелеобразующих систем. Обе инкапсулированные формы затем подвергали двухэтапному протоколу тестирования, при котором их сначала подвергали воздействию кислой, а затем кишечной среды pH. Слабоосновные молекулы обычно переходят от низкого к высокому pH с падением растворимости. Однако капсула ГПМЦ значительно улучшила рас творимость по сравнению с желатиновым продуктом, при этом концентрация эрлотиниба примерно в два раза выше. Это показало, что ГПМЦ не только может использоваться для увеличения растворимости слабоосновных молекул, но и что капсула ГПМЦ действует в этом случае как функциональный наполнитель и необязательно должна находиться в составе, чтобы вызвать этот эффект.
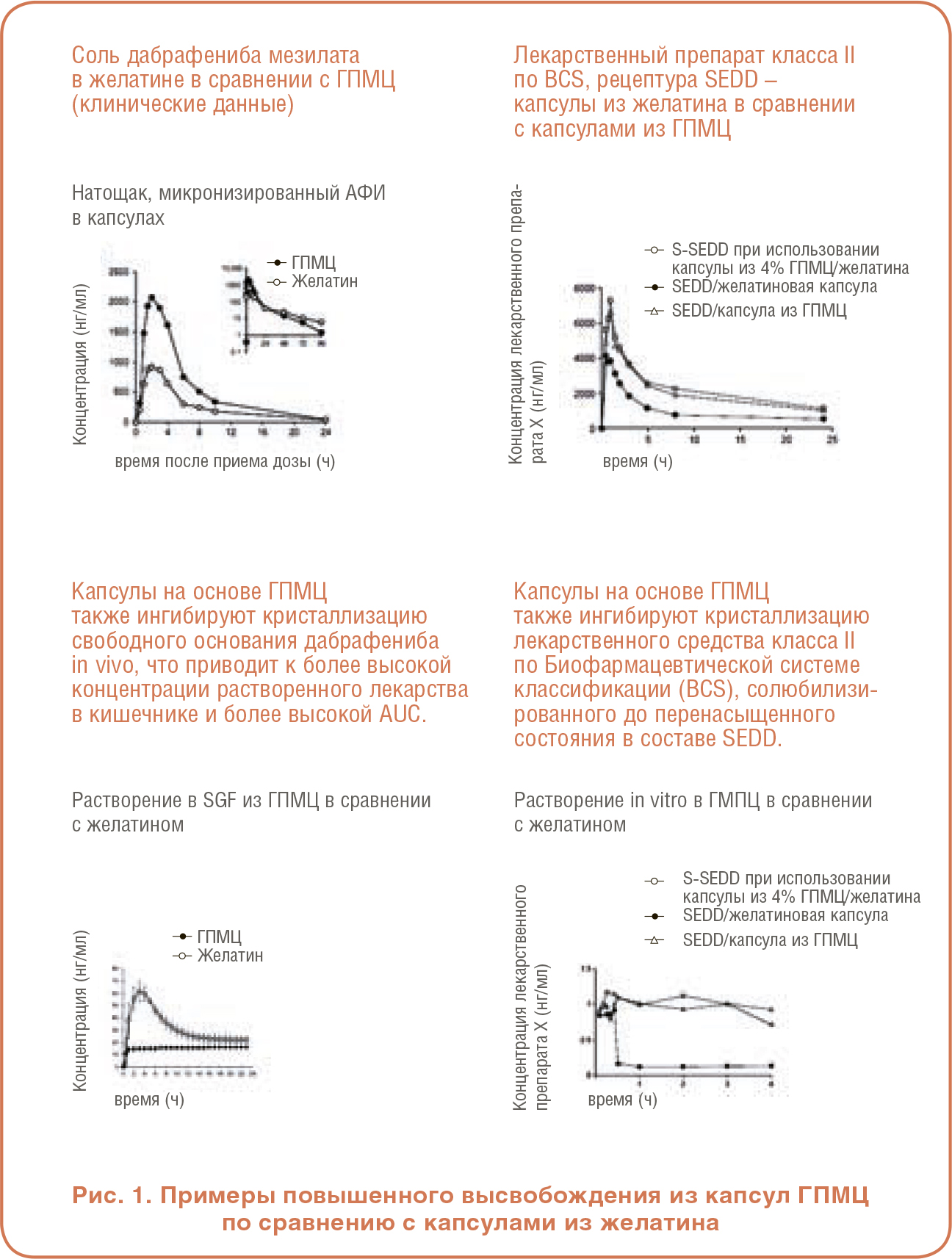
На Рисунке 5 представлены дополнительные примеры увеличения воздействия лекарственного средства при использовании капсул из ГПМЦ по сравнению с желатином. Вверху слева представлен график, показывающий постоянно более высокую концентрацию дабрафениба мезилата в крови в течение 24 часового периода у пациентов, получавших препараты, инкапсулированные в ГПМЦ, по сравнению с теми же препаратами в желатине. Аналогичным образом, результаты растворения в нижнем левом углу показывают, что концентрация растворенного дабрафениба в капсуле ГПМЦ значительно превышает концентрацию препарата в желатиновой капсуле. Графики в правой части рисунка 5 показывают аналогичную картину результатов аналогичного исследования уникальной рецептуры SEDD. Это приводит к выводу, что перенасыщение может быть достигнуто без быстрой кристаллизации как в рецептурах на основе липидов, так и в аморфных твердых дисперсионных рецептурах, и что ГПМЦ, присутствующая в капсуле, участвует в этом эффекте.
 ПРИМЕРЫ ВЫБОРА КАПСУЛ
ПРИМЕРЫ ВЫБОРА КАПСУЛ
Поскольку капсула выступает в качестве функционального вспомогательного вещества, выбор капсулы становится особенно важным. Важно не иметь гелеобразующую систему в ГПМЦ, чтобы она работала с эквивалентом капсул из желатина in vivo с немедленным высвобождением. Необходимы хорошие характеристики растворения независимо от pH и ионной силы среды.
У ГПМЦ есть дополнительное преимущество, заключающееся в предотвращении сшивания, которое представляет риск для желатина, когда полимеры используются для производства ASD, а также она лучше способна контролировать чувствительность к влаге, которая может возникать как с ASD, так и с LBF. Кроме того, как полимер на растительной основе, ГПМЦ является широко применимым материалом.
ЗАКЛЮЧЕНИЕ
Обеспечение адекватной биодоступности низкорастворимых АФИ – это постоянная проблема фармацевтических открытий и разработок, которая ставит перед разработчиками рецептур множество проблем. Для решения этой проблемы наиболее широко используются две стратегии: рецептура на основе липидов и аморфная твердая дисперсия, обе из которых требуют подходящей инкапсуляции в твердые лекарственные формы для перорального применения. Как рецептура, так и капсула играют важную роль в преодолении проблем биодоступности и повышении всасывания плохо усваиваемых АФИ. Новая технология позволяет получать капсулы, которые сами по себе могут выступать в качестве функциональных вспомогательных веществ, и правильный выбор капсулы для сложной рецептуры имеет решающее значение для её успеха.
 Контакты:
Контакты:
Представительство в России: «ООО Капсугель»
142000, Московская область г. Домодедово, ул. Логистическая д. 1/6
Телефон: +7(495)795-37-77
E-mail: ru@lonza.com
Web: www.capsugel.ru
Список литературы:
1. PharmaCircle™, About PharmaCircle, https://www.pharmacir-cle.com/info/about/, доступ получен 22 июля 2021 г.
2. H. D. Williams, et al., (2013). Pharmacol. Ред. 65 (1) 315–499, doi: 10.1124/pr.112.005660 (2013).
3. B. J. Boyd, et al., Eur. J. Pharm. Sci. 137, 104967, doi: 10.1016/j.ejps.2019.104967 (2019).
4. Z. Vinarov Z, et al., Adv. Drug Deliv. Rev. 171, 289–331, doi: 10.1016/j.addr.2021.02.001 (2021).
5. C. W. Pouton, Eur. J. Pharm. Sci. 11(2) S93–S98, doi: 10.1016/ s0928–0987(00)00167–6 (2000).
6. C. W. Pouton, Eur. J. Pharm. Sci. 29 (3–4), 278–287, doi: 10.1016/j.ejps.2006.04.016 (2006).
7. В. Jannin, Curr. Drug Deliv. 15 (6) 749–751, doi: 10.2174/1567 201814666171018120817 (2018).
8. J. Griesser, Int. J. Pharm. 538 (1–2) 159–166, doi: 10.1016/j. ijpharm.2018.01.018 (2018).
9. F. McCartney, et al., J. Control. Отн. 310, 115–126, doi: 10.1016/j.jconrel.2019.08.008 (2019).
10. J. Brouwers, M. E. Brewster, and P. Augustinjs, J. Pharm. Sci. 98, 2549–2572, doi: 10.1002/jps.21650 (2009).
11. Видео: https://www.youtube.com/watch?v=Jbh4CPdKmt8.
 ООО «ТОФФЛОН РУС»
ООО «ТОФФЛОН РУС»


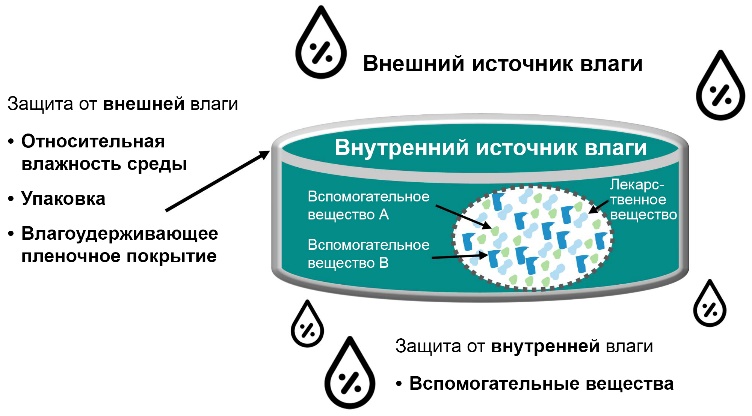
 Поддержание низкого уровня относительной влажности среды представляет собой очевидную, но недостаточно реалистичную стратегию. Подходящая упаковка позволяет очень эффективно защитить лекарственную форму от воды, содержащейся в воздухе (влажность).
Поддержание низкого уровня относительной влажности среды представляет собой очевидную, но недостаточно реалистичную стратегию. Подходящая упаковка позволяет очень эффективно защитить лекарственную форму от воды, содержащейся в воздухе (влажность).
 МЕХАНИЧЕСКИЕ СВОЙСТВА ИЗОЛИРОВАННЫХ ПЛЕНОК
МЕХАНИЧЕСКИЕ СВОЙСТВА ИЗОЛИРОВАННЫХ ПЛЕНОК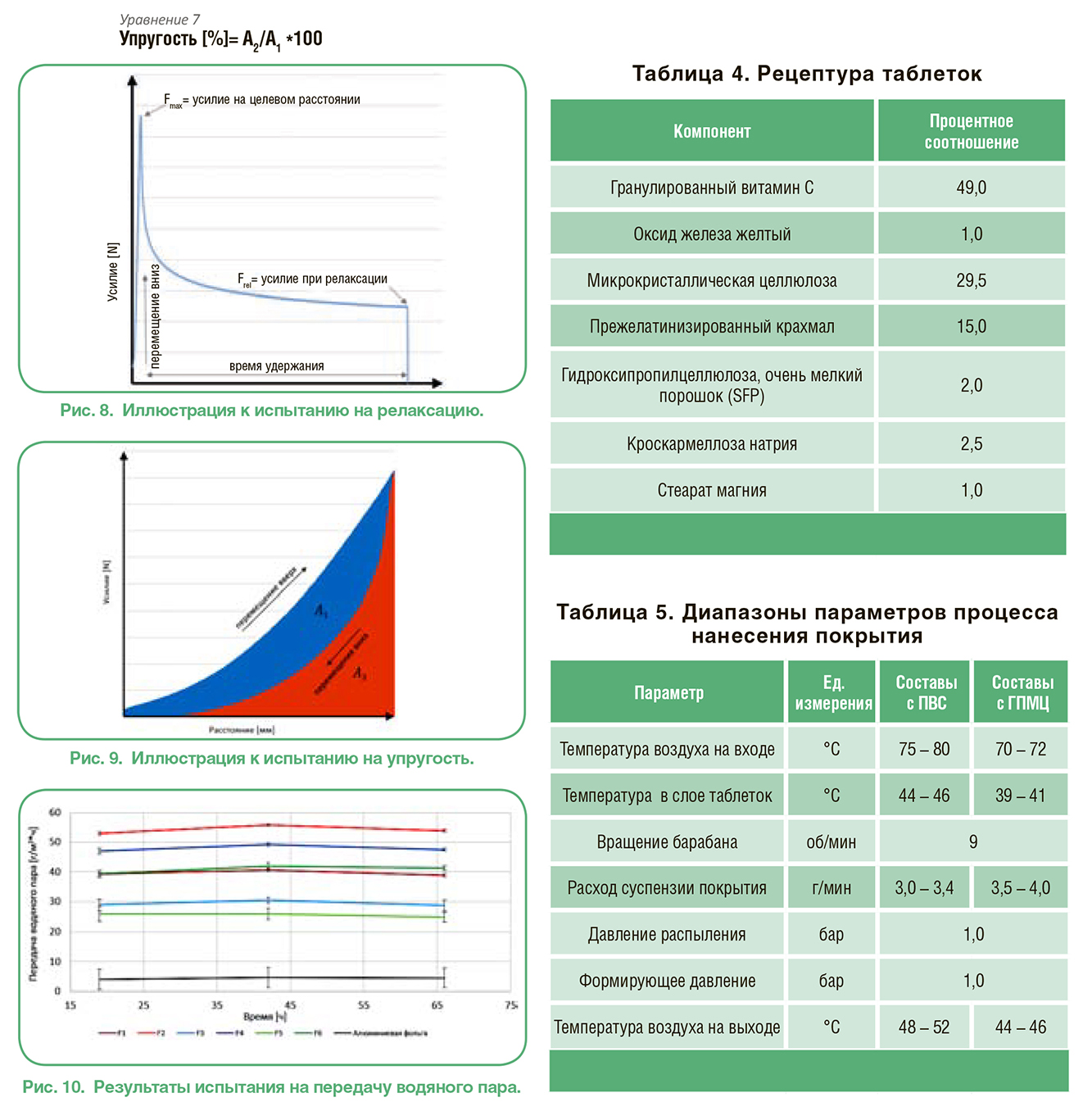 ПРИГОТОВЛЕНИЕ ТАБЛЕТОК
ПРИГОТОВЛЕНИЕ ТАБЛЕТОК НАНЕСЕНИЕ ПОКРЫТИЯ НА ТАБЛЕТКИ
НАНЕСЕНИЕ ПОКРЫТИЯ НА ТАБЛЕТКИ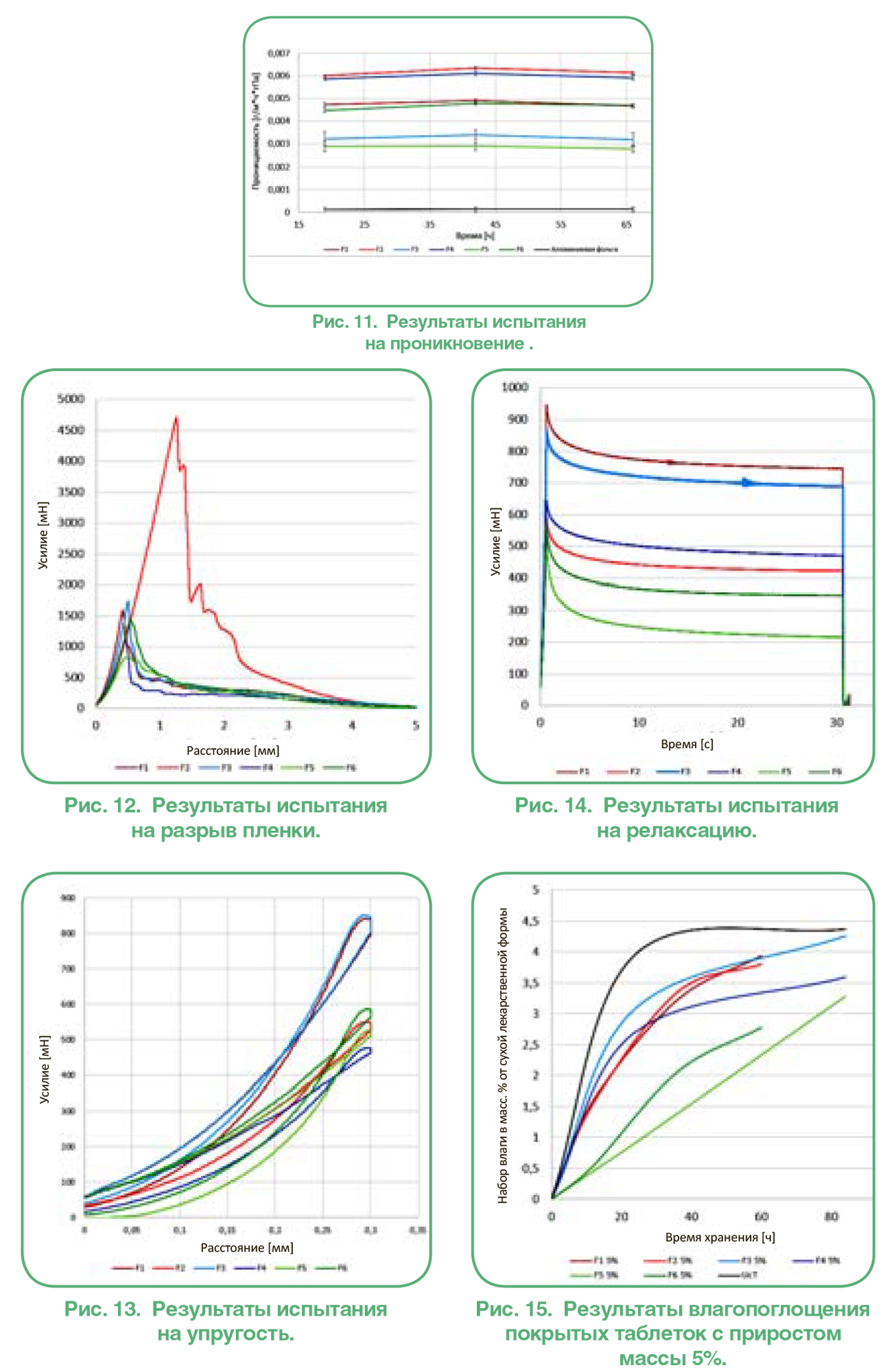






 ИСПОЛЬЗОВАНИЕ СУЩЕСТВУЮЩИХ РЕШЕНИЙ LONZA
ИСПОЛЬЗОВАНИЕ СУЩЕСТВУЮЩИХ РЕШЕНИЙ LONZA ООО «Капсугель»
ООО «Капсугель»



 РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ
РАБОТА С АМОРФНЫМИ ТВЕРДЫМИ ДИСПЕРСИЯМИ УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА
УЛУЧШЕНИЕ УСТОЙЧИВОСТИ СОЛЮБИЛИЗАЦИИ И ВСАСЫВАНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ПРИМЕРЫ ВЫБОРА КАПСУЛ
ПРИМЕРЫ ВЫБОРА КАПСУЛ

 МЕТОД
МЕТОД 
 ЗАКЛЮЧЕНИЕ
ЗАКЛЮЧЕНИЕ

 В настоящее время на рынке ТЛФ для приема внутрь преобладает доля прессованных таблеток, однако твердые капсулы лишь немного проигрывают им, при этом интерес в приме препаратов именно в такой форме становится все выше. Причиной этому служит, главным образом, тот факт, что технологи-разработчики рассматривают капсулирование в качестве надежного метода доставки для широкого спектра соединений, включая сильнодействующие АФС. В 2018 году приблизительно 25 процентов новых химических соединений были отнесены к «сильнодействующим». Такая тенденция в основном связана с тем, что около одной трети всех препаратов-кандидатов в разработке являются средствами лечения онкологических заболеваний. Из 31 лекарственных средств против рака с новой молекулярной основой в твердой форме, зарегистрированных в 2018 году, семь были представлены в виде капсул.
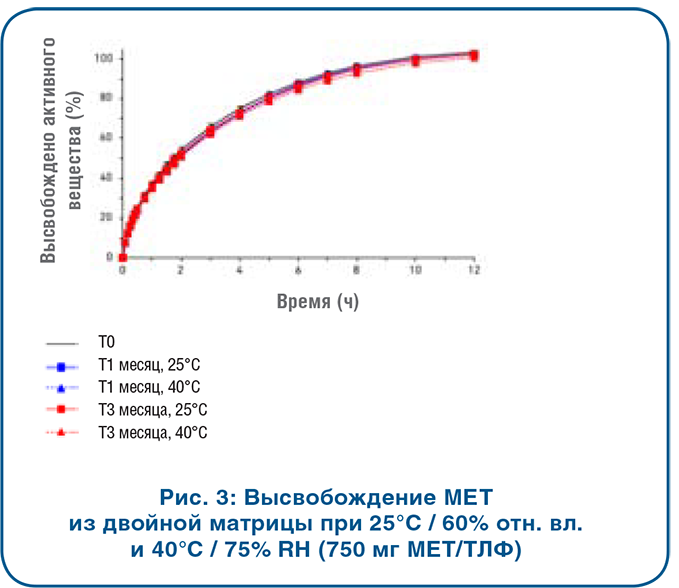
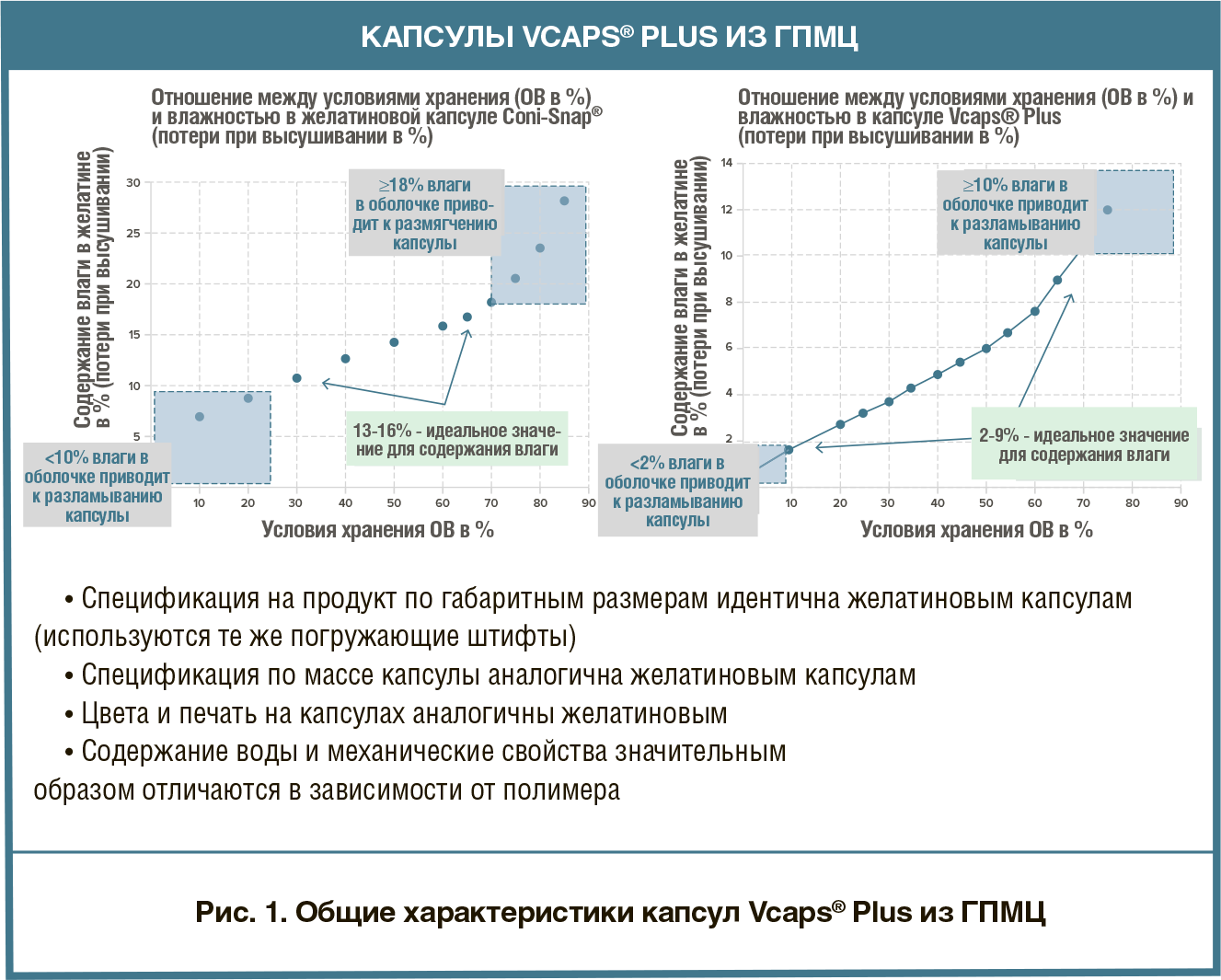
В настоящее время на рынке ТЛФ для приема внутрь преобладает доля прессованных таблеток, однако твердые капсулы лишь немного проигрывают им, при этом интерес в приме препаратов именно в такой форме становится все выше. Причиной этому служит, главным образом, тот факт, что технологи-разработчики рассматривают капсулирование в качестве надежного метода доставки для широкого спектра соединений, включая сильнодействующие АФС. В 2018 году приблизительно 25 процентов новых химических соединений были отнесены к «сильнодействующим». Такая тенденция в основном связана с тем, что около одной трети всех препаратов-кандидатов в разработке являются средствами лечения онкологических заболеваний. Из 31 лекарственных средств против рака с новой молекулярной основой в твердой форме, зарегистрированных в 2018 году, семь были представлены в виде капсул.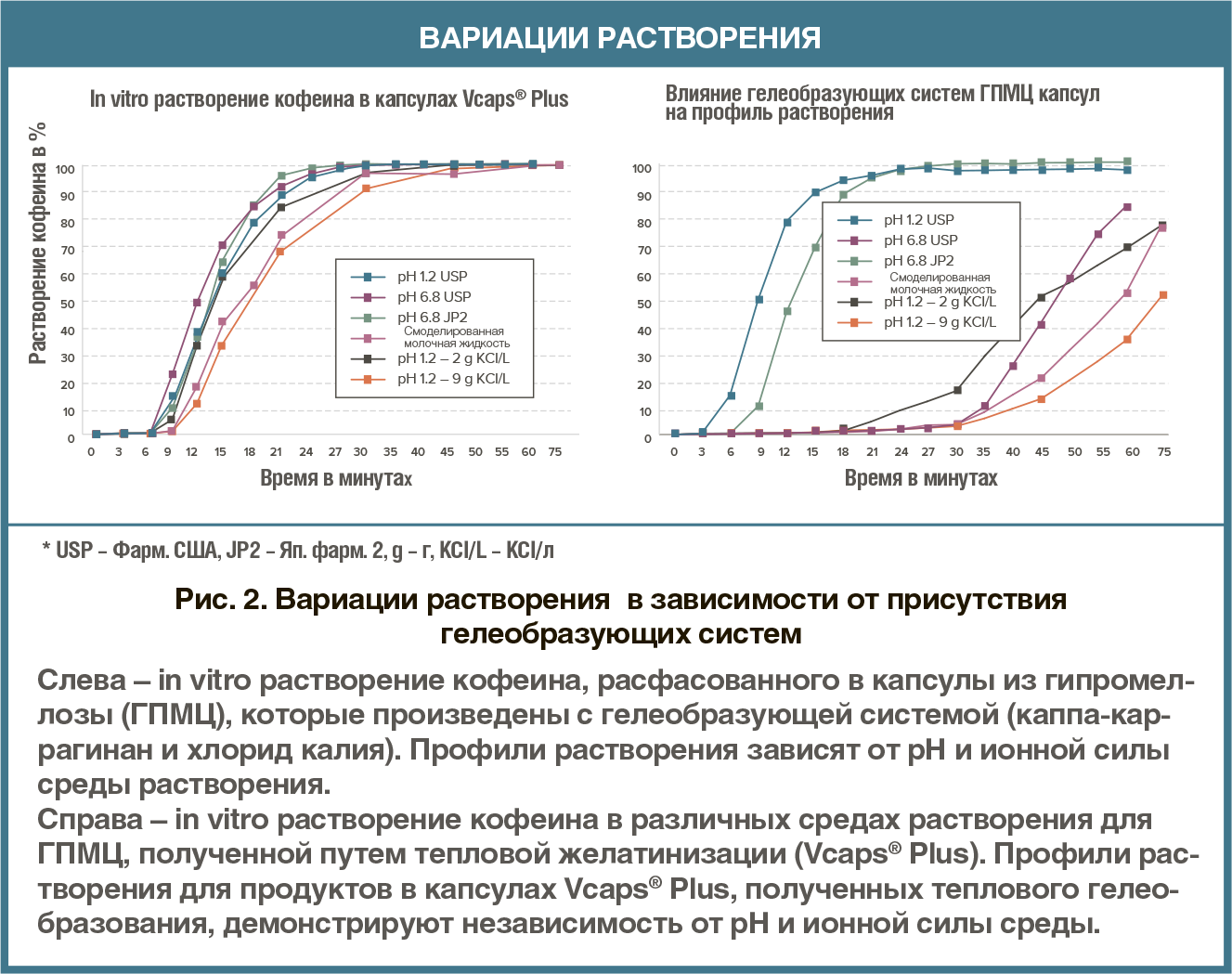 быть эквивалентным аналогом желатиновых капсул. Капсулы из ГПМЦ могут производиться с гелеобразующей системой или без нее. В случае использования гелеобразующей системы всегда будет иметь место вариации в растворении. На рис. 2 продемонстрирована изменчивость при in vitro растворении заполненных кофеином капсул из ГПМЦ, которые были получены с использованием гелеобразующей системы.Препараты, фасуемые в капсулы из ГПМЦ без гелеобразующей системы, не характеризуются такой изменчивостью. К примеру, капсулы Capsugel’s Vcaps® Plus производят с помощью процесса терможелирования собственной разработки, который характеризуется надежностью растворения вне зависимости от изменения рН и ионной силы (рис. 2).
быть эквивалентным аналогом желатиновых капсул. Капсулы из ГПМЦ могут производиться с гелеобразующей системой или без нее. В случае использования гелеобразующей системы всегда будет иметь место вариации в растворении. На рис. 2 продемонстрирована изменчивость при in vitro растворении заполненных кофеином капсул из ГПМЦ, которые были получены с использованием гелеобразующей системы.Препараты, фасуемые в капсулы из ГПМЦ без гелеобразующей системы, не характеризуются такой изменчивостью. К примеру, капсулы Capsugel’s Vcaps® Plus производят с помощью процесса терможелирования собственной разработки, который характеризуется надежностью растворения вне зависимости от изменения рН и ионной силы (рис. 2).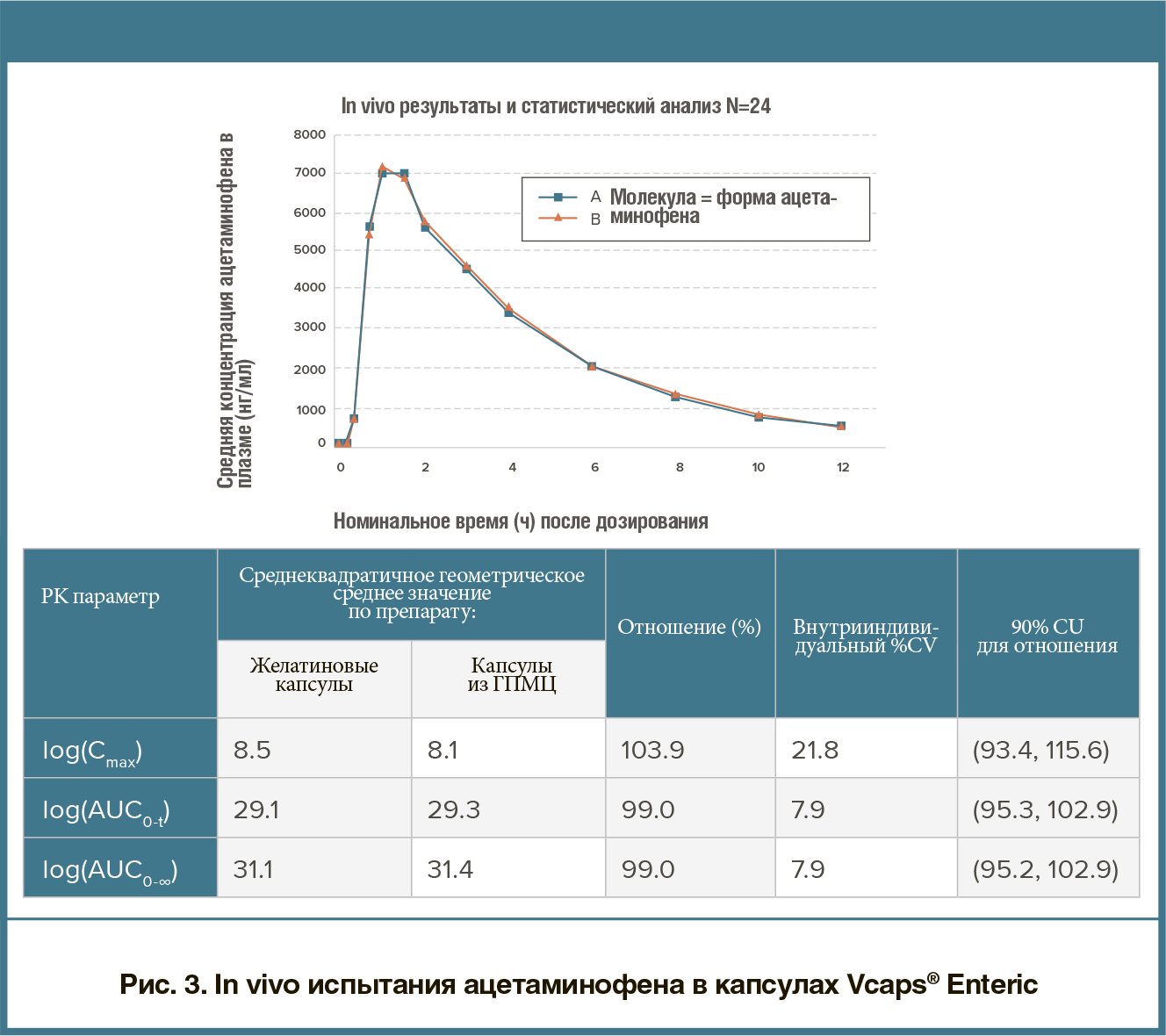 капсулы Vcaps® Plus из ГПМЦ — каплеты General Excedrin® Extra Strength, так как они содержат три разных биомаркера (т.е. для ацетаминофена, аспирина и кофеина). Каплет Excedrin® Extra Strength добавляли как в капсулу Vcaps® Plus из ГПМЦ, так и в твердую желатиновую капсулу. Капсулы дозировали согласно протоколу исследования и собирали данные по различным фармакокинетическим параметрам.Результаты испытания с использованием маркера ацетаминофена продемонстрировали, что ни отличие в типе полимера, ни незначительное запаздывание растворения ГПМЦ не повлияли на эффективность продукта in vivo (рис. 3). Обе капсулы показали практически идентичную эффективность с высокими доверительными интервалами. Результаты испытания с маркерами аспирина и кофеина подтверждают ту же эффективность in vivo, что зарегистрирована для маркера ацетаминофена, демонстрируя тесное согласование с результатами по продукции в желатиновых капсулах с высокими доверительными интервалами в каждом случае. Данное исследование доказывает, что капсулы из ГПМЦ могут расширить возможности для применения капсул при разработке и производстве препаратов, при условии, что капсулы выпускают без гелеобразующей системы.
капсулы Vcaps® Plus из ГПМЦ — каплеты General Excedrin® Extra Strength, так как они содержат три разных биомаркера (т.е. для ацетаминофена, аспирина и кофеина). Каплет Excedrin® Extra Strength добавляли как в капсулу Vcaps® Plus из ГПМЦ, так и в твердую желатиновую капсулу. Капсулы дозировали согласно протоколу исследования и собирали данные по различным фармакокинетическим параметрам.Результаты испытания с использованием маркера ацетаминофена продемонстрировали, что ни отличие в типе полимера, ни незначительное запаздывание растворения ГПМЦ не повлияли на эффективность продукта in vivo (рис. 3). Обе капсулы показали практически идентичную эффективность с высокими доверительными интервалами. Результаты испытания с маркерами аспирина и кофеина подтверждают ту же эффективность in vivo, что зарегистрирована для маркера ацетаминофена, демонстрируя тесное согласование с результатами по продукции в желатиновых капсулах с высокими доверительными интервалами в каждом случае. Данное исследование доказывает, что капсулы из ГПМЦ могут расширить возможности для применения капсул при разработке и производстве препаратов, при условии, что капсулы выпускают без гелеобразующей системы.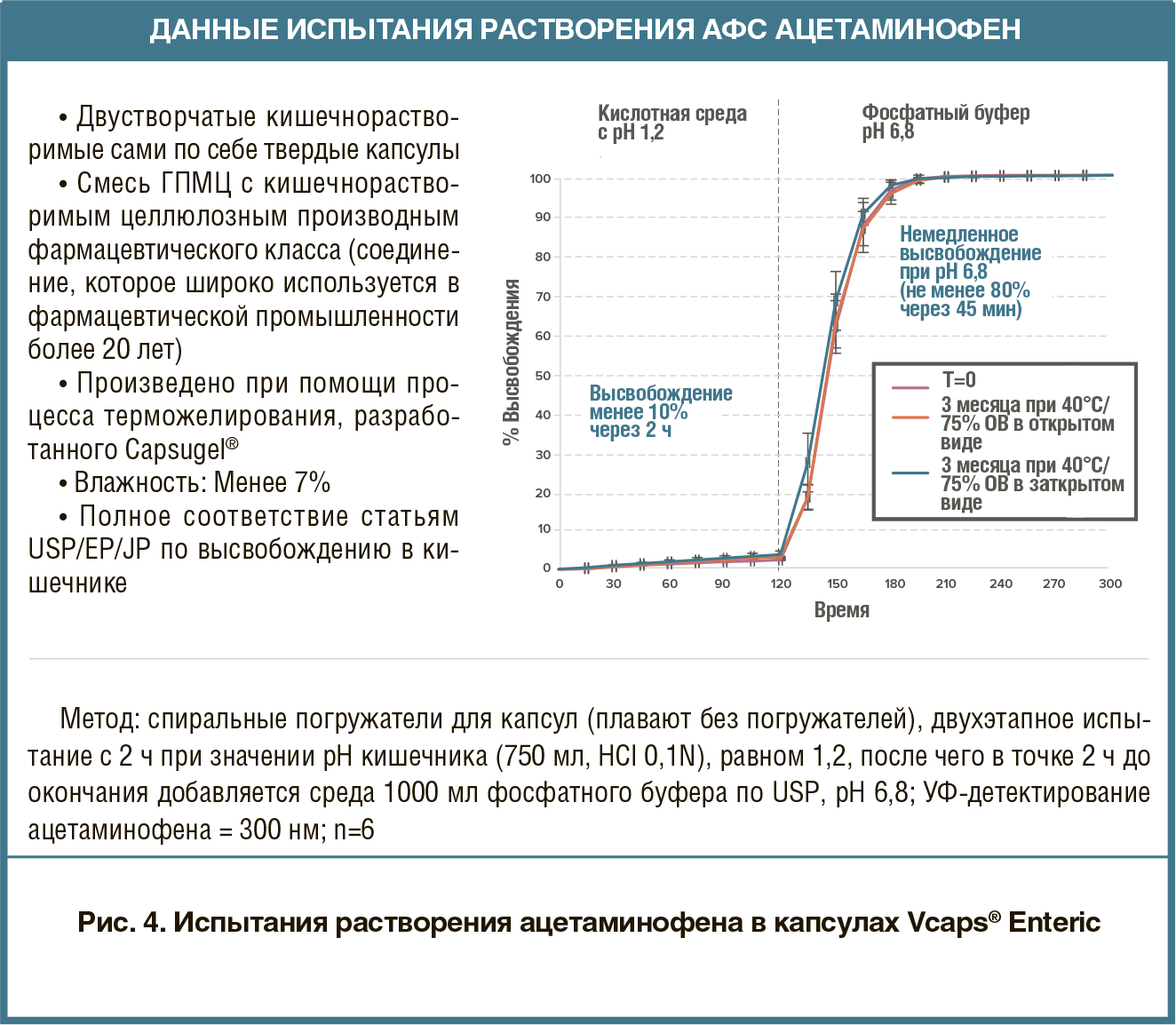 капсулирования (капсулы Vcaps® Enteric от компании Capsugel®) обеспечивает защиту в кишечнике и отсроченное высвобождение без необходимости нанесения функционального покрытия. Использование технологами на ранних этапах разработки препаратов несложных вариантов, гарантирующих растворение в кишечнике, оптимизирует процесс оценки новых химических соединений, требующих кислотной защиты.Твердые капсулы Vcaps® Enteric получают при помощи процесса терможелировния ГПМЦ с кишечнорастворимыми целлюлозными материалами. Кишечнорастворимые свойства капсулы заложены в самом полимере, а не во внешней оболочке. Кроме того, капсулы не требуют дополнительных этапов обработки, таких как запайка или бандажирование.В рамках двухэтапного протокола испытаний менее 10% продукта высвобождалось в течение двух часов при значении рН кишечника. Быстрое высвобождение достигалось при размещении капсулы в буфере с более высоким рН на втором этапе (рис. 4).
капсулирования (капсулы Vcaps® Enteric от компании Capsugel®) обеспечивает защиту в кишечнике и отсроченное высвобождение без необходимости нанесения функционального покрытия. Использование технологами на ранних этапах разработки препаратов несложных вариантов, гарантирующих растворение в кишечнике, оптимизирует процесс оценки новых химических соединений, требующих кислотной защиты.Твердые капсулы Vcaps® Enteric получают при помощи процесса терможелировния ГПМЦ с кишечнорастворимыми целлюлозными материалами. Кишечнорастворимые свойства капсулы заложены в самом полимере, а не во внешней оболочке. Кроме того, капсулы не требуют дополнительных этапов обработки, таких как запайка или бандажирование.В рамках двухэтапного протокола испытаний менее 10% продукта высвобождалось в течение двух часов при значении рН кишечника. Быстрое высвобождение достигалось при размещении капсулы в буфере с более высоким рН на втором этапе (рис. 4).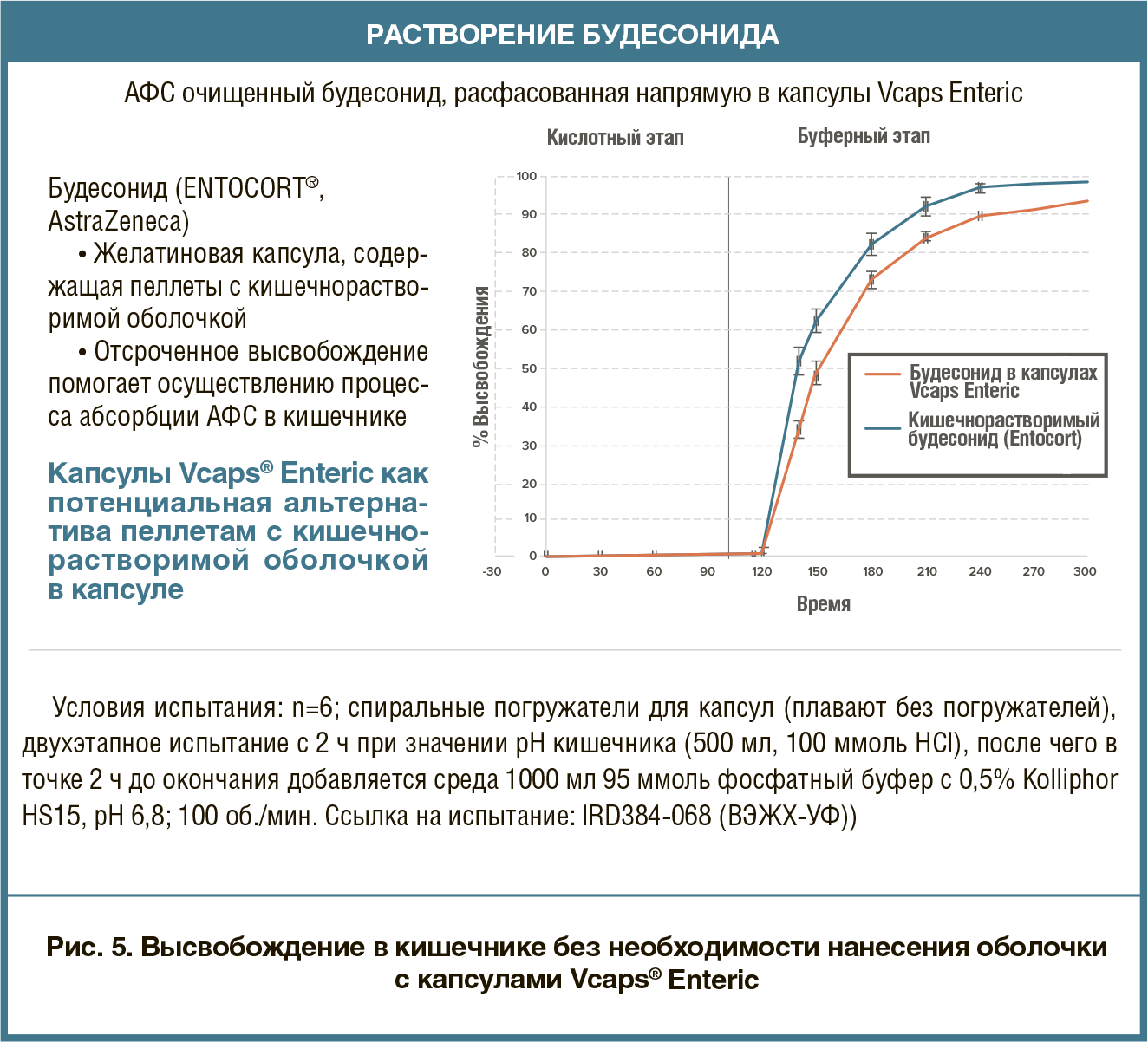




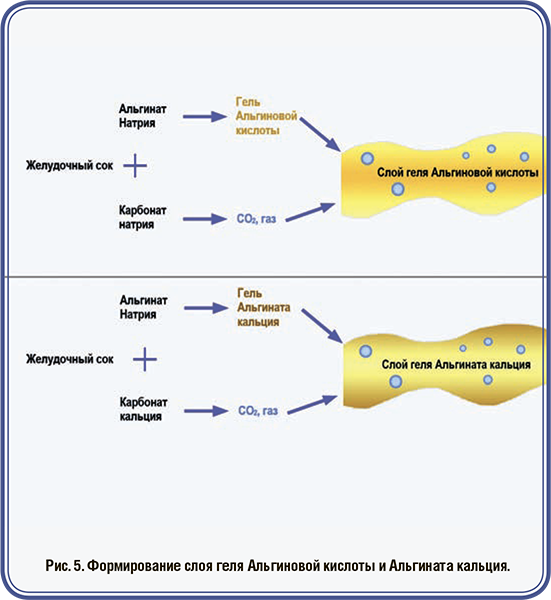
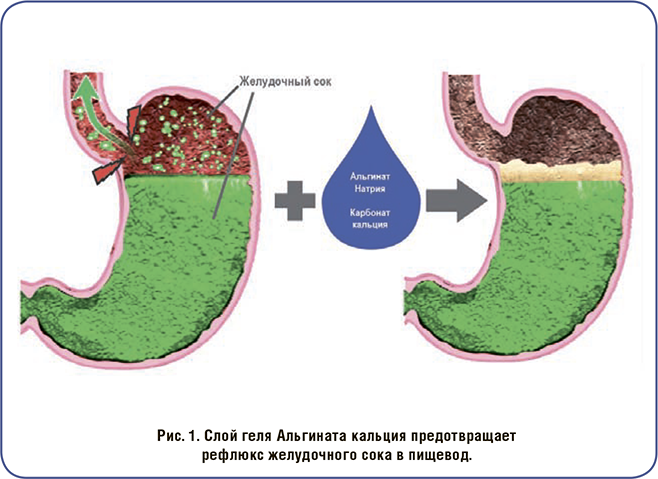 Рефлюкс желудочного сока в пищеводе может привести к изжоге и, в хронических случаях, к гастроэзофагеальной рефлюксной болезни. Симптомы изжоги — кислый/ горький вкус в задней части горла и во рту, а также жгучая боль в пищеводе, которая может отдавать в грудную клетку и напоминать сердечные боли. Хронический рефлюкс может привести к более тяжелым последствиям, таким как гастроэзофагеальная рефлюксная болезнь, которая поражает до 30% взрослых людей. Долгосрочный рефлюкс желудочного сока может повредить слизистую оболочку пищевода, приводя к воспалению, начальным стадиям рака, язвам и кровотечениям, сужению пищевода из-за образования рубцов.
Рефлюкс желудочного сока в пищеводе может привести к изжоге и, в хронических случаях, к гастроэзофагеальной рефлюксной болезни. Симптомы изжоги — кислый/ горький вкус в задней части горла и во рту, а также жгучая боль в пищеводе, которая может отдавать в грудную клетку и напоминать сердечные боли. Хронический рефлюкс может привести к более тяжелым последствиям, таким как гастроэзофагеальная рефлюксная болезнь, которая поражает до 30% взрослых людей. Долгосрочный рефлюкс желудочного сока может повредить слизистую оболочку пищевода, приводя к воспалению, начальным стадиям рака, язвам и кровотечениям, сужению пищевода из-за образования рубцов.

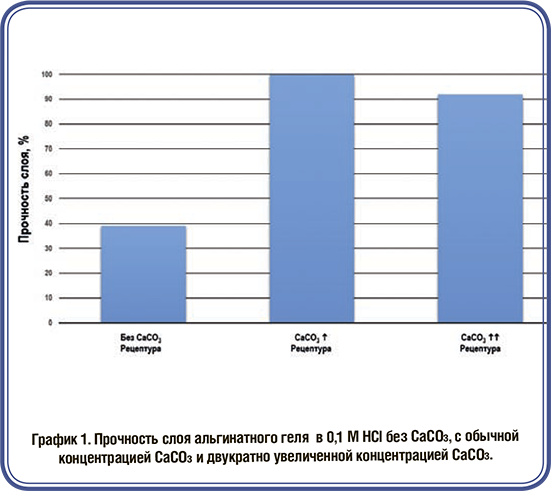

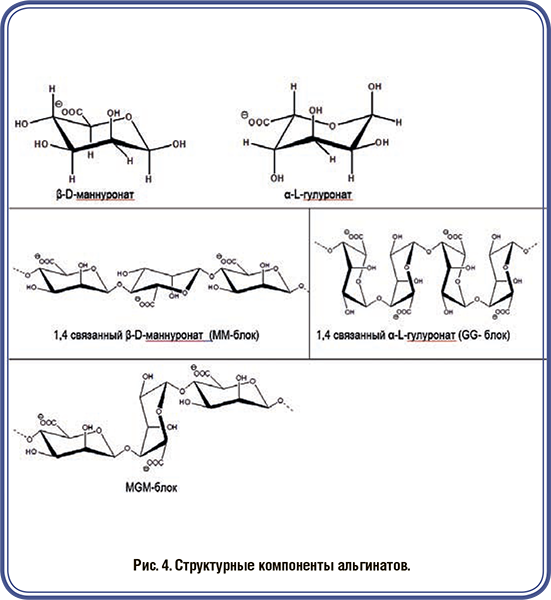

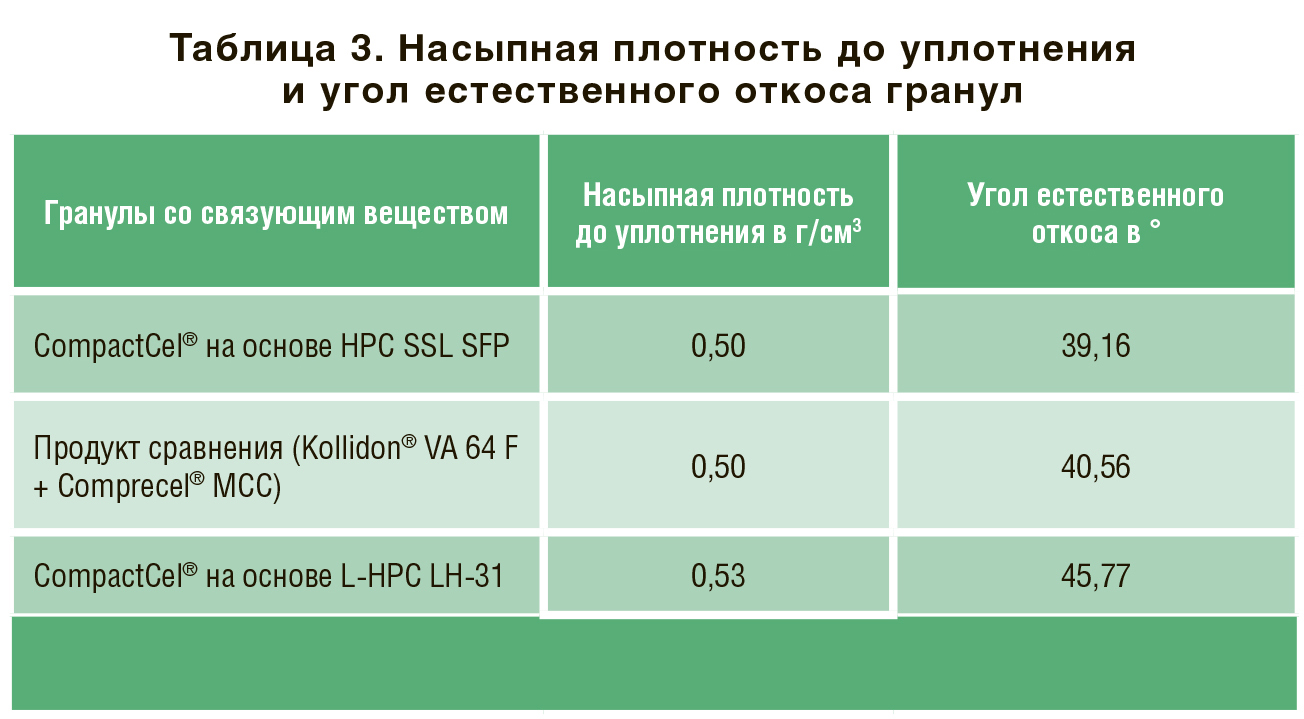
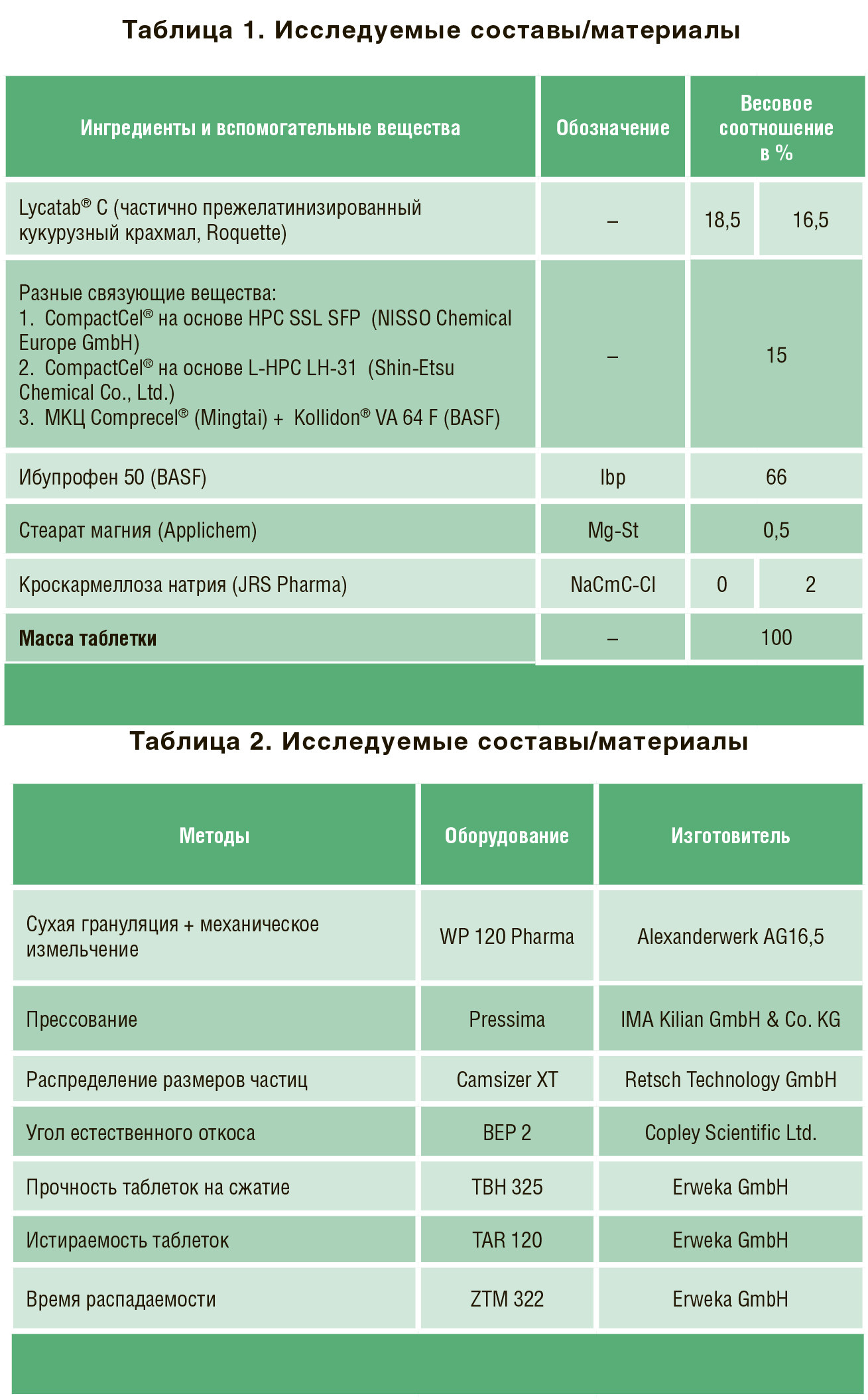 Сухая грануляция (вальцевание) как непрерывный процесс, становится все более важной для фармацевтической и смежных отраслей. Этим объясняется растущий интерес к различным материалам и их обработке. Одним из негативных аспектов вальцевания является эффект затвердевания. Термин «эффект затвердевания» означает, что гранулы часто демонстрируют пониженную прочность на разрыв по сравнению с прямым сжатием. Использование сухого связующего агента CompactCel® позволяет улучшить механические свойства и уменьшить эффект затвердевания.
Сухая грануляция (вальцевание) как непрерывный процесс, становится все более важной для фармацевтической и смежных отраслей. Этим объясняется растущий интерес к различным материалам и их обработке. Одним из негативных аспектов вальцевания является эффект затвердевания. Термин «эффект затвердевания» означает, что гранулы часто демонстрируют пониженную прочность на разрыв по сравнению с прямым сжатием. Использование сухого связующего агента CompactCel® позволяет улучшить механические свойства и уменьшить эффект затвердевания.
 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ